文献解读
TPJ2017-赖氨酸乙酰化蛋白质组学揭示参与植物减数分裂和绒毡层功能中的乙酰化蛋白
发布日期:2020-05-28 2:07 浏览: 4,158 views次
蛋白赖氨酸乙酰化(KAC)是真核生物和原核生物中发现的另一种可逆的动态PTM。虽然KAC最初是在组蛋白修饰中发现的,但它被发现存在于大量的蛋白质中。作为世界上的主要作物之一,水稻(Oryzaativa)为大量人口提供了大量的食物。在开花植物中,花药是雄性生殖器官,产生花粉粒,传递精子细胞进行双受精。 在花药发育过程中,减数分裂产生单倍体子细胞,由于同源染色体之间的减数分裂重组,它们携带不同的遗传物质。 因此,对水稻花药在基因和蛋白质水平上参与发育的分子机制和蛋白质网络有新的见解是非常重要的。近来在开花植物中,一项研究在水稻悬浮细胞中检测到44个乙酰化蛋白和60个KAC位点。 在草莓叶片分析中发现684个蛋白质和1392个乙酰化位点。 最近的另一项研究在营养期水稻植株的716个乙酰化蛋白上检测到1337个KAC位点。在该文中,作者报告了蛋白质组学研究的结果,以检测发育中的水稻花药在减数分裂(RAM)时间附近的KAC状态,为许多受KAC影响的蛋白质在水稻花药发育和减数分裂过程中的作用提供了强有力的生化证据。 一共鉴定得到676个蛋白质和1354个KAC位点。 其中,421个乙酰化蛋白与629个KAC位点是新的,大大丰富了开花植物中对KAC的知识。 基因本体富集分析表明,染色质沉默、蛋白质折叠、脂肪酸生物合成过程和应激反应被过度表达。 此外,还检测到RAM中某些潜在特异性的KAC基序。重要的是,共有357个水稻减数分裂细胞蛋白乙酰化;在14个KAC位点上,共有4个对水稻绒毡层和花粉发育具有重要遗传意义的蛋白乙酰化。同时47种推测的分泌蛋白在RAM中表现出乙酰化状态。 此外,通过比较本文中赖氨酸乙酰体和作者以前获得的RAM磷蛋白组,提出了KAC与磷酸化之间的相关性,作为水稻RAM中潜在的调节机制。 本研究首次对KAC在植物生殖发育中的作用进行了全球调查,为进一步研究KAC在水稻花药发育和减数分裂中的作用奠定了基础。

1.RAM中赖氨酸乙酰化蛋白的整体结果
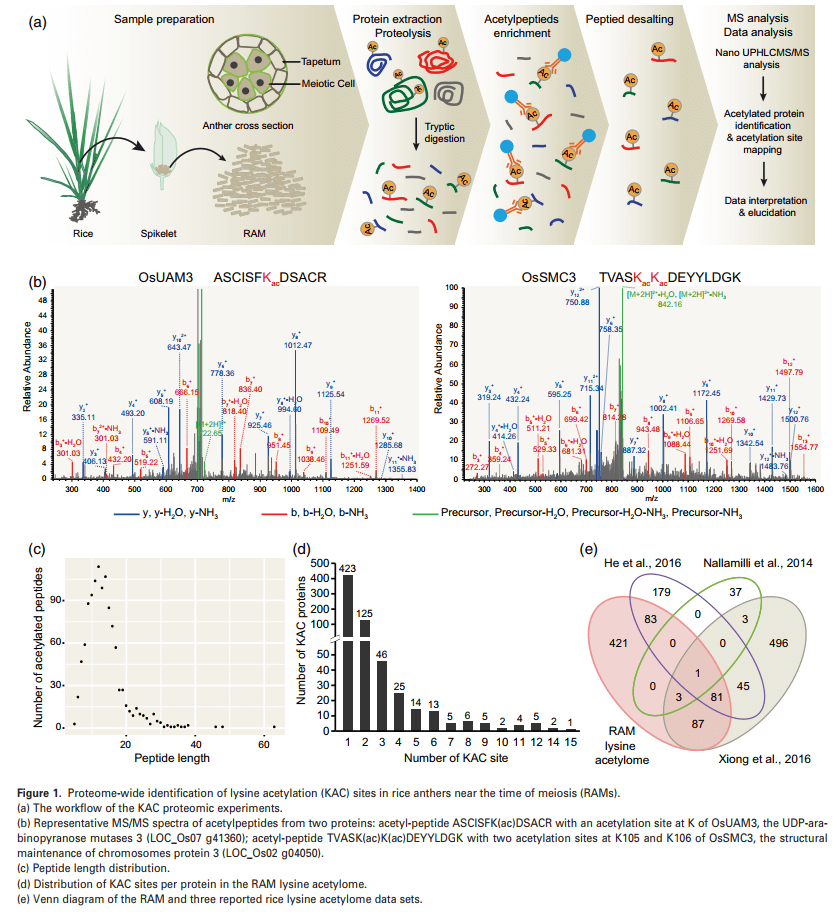
作者通过乙酰化蛋白质组学分析KAC在水稻减数分裂和花药发育中的作用,一共鉴定得到1118个赖氨酸乙酰化肽,它们分别对应676个蛋白上的1354个不同的KAC位点。乙酰化肽的长度范围为5 ~ 63个氨基酸,其中91%的长度范围为5 ~ 20个氨基酸(图1C)。单个蛋白中KAC位点的数量在不同蛋白之间也有很大差异。在676个乙酰化蛋白中,423个、125个和46个分别有1个、2个和3个KAC位点(图1D)。在含有4个或4个以上KAC位点的82个蛋白中,KAC位点数量最多的是组蛋白(LOC_Os01 g05970)。
之前一些研究已经在水稻中鉴定出一些KAC蛋白,但所用材料主要集中在某些营养细胞或器官上,包括悬浮细胞、种子胚胎和整个幼苗。将本文数据与之前的研究相比发现了421个具有629个乙酰化位点的新型KAC蛋白(图1E);同时在255个乙酰化蛋白中检测到421个新的KAC位点,这些蛋白中至少有一部分可能被植物和生殖组织/器官之间不同的KAC位点所调节。因此该研究的数据不仅极大地扩展了植物蛋白KAC的数据集,而且为水稻花药发育和减数分裂过程中KAC蛋白的功能研究奠定了基础。
2. RAM中KAC蛋白的亚细胞分布及富集分析
通过GO富集分析发现胞质所占比例最大,其次为膜和核(图2A),特别是12.3%,10.2%,2.7%和1.5%的KAC蛋白分别位于叶绿体、线粒体、内质网(ER)和染色体上。同时发现10个KAC非组蛋白被标注为与染色体相关的蛋白。
通过蛋白域富集分析(图2B)发现19个结构域家族被富集,主要包括组蛋白和代谢及应激反应蛋白。其中三个域家族,包括AAA家族、DEAD/DEAH box解旋酶和AIG1家族,显著富集。
通过GO分析(生物学过程、细胞成分和分子功能)(图2C)表明:在生物过程方面,16个GO项(包括对镉离子的反应、蛋白质折叠和复性、核糖体的生物发生、翻译和对胁迫的反应)显著富集;其中,5个KAC蛋白在染色质沉默过程中被鉴定,另外5个蛋白在细胞板形成过程中参与胞质分裂。同时发现还有4个与孢粉素生物合成相关的蛋白和8个与脂肪酸生物合成相关的蛋白被乙酰化。在细胞成分方面,发现有421个KAC蛋白主要分布在细胞质、细胞膜、细胞核和叶绿体上,这与获得的总KAC蛋白的亚细胞分布相似(图2A和C)。在分子功能方面,与核糖体结构成分、蛋白结合和酶活性相关的蛋白高度富集。
3. RAM中赖氨酸乙酰化基序
作者通过iceLogo motif builder分析RAM中KAC蛋白是否显示出相似或不同的氨基酸序列偏好(分析了1133个乙酰化赖氨酸肽序列),发现其含有15个氨基酸残基的乙酰肽序列,其中包括KAC位点上游和下游的7个氨基酸残基,在+1位置有酪氨酸(Y)、苯丙氨酸(F)或组氨酸(H)的富集,在1位置有F的富集(图3A)。考虑到组蛋白在细胞分裂,特别是减数分裂过程中染色体动力学的重要作用,以及该研究中发现的大量乙酰化位点,作者仅对乙酰化的组蛋白进行了motif分析,在+1位置发现了一个优先的K,并且K在整个motif中富集(图3B),这与之前报道的恶性疟原虫的模式明显不同。
对KAC基序的特异性分析表明,细胞质蛋白在1位对天冬氨酸(D)有显著的富集作用,而不包括组蛋白的核酸蛋白则表现为首选苏氨酸(T)(图3C和D)。 同时使用NetSurfP1.1分析了乙酰化赖氨酸周围的蛋白质二级结构,发现乙酰化赖氨酸对a-螺旋表现出适度的偏好。
4. 在RAM发育过程中,组蛋白中存在大量赖氨酸乙酰化位点
蛋白质赖氨酸乙酰化是组蛋白的重要可逆修饰,影响真核生物的基因表达、局部染色质状态和较高染色质结构的形成。组蛋白乙酰化的稳态是通过组蛋白乙酰转移酶(HATs)和组蛋白去乙酰化酶(HDACs)的酶活性之间的动态平衡来维持的。 水稻减数分裂中的转录组分析检测到8个HATs和11个HDACs被转录。
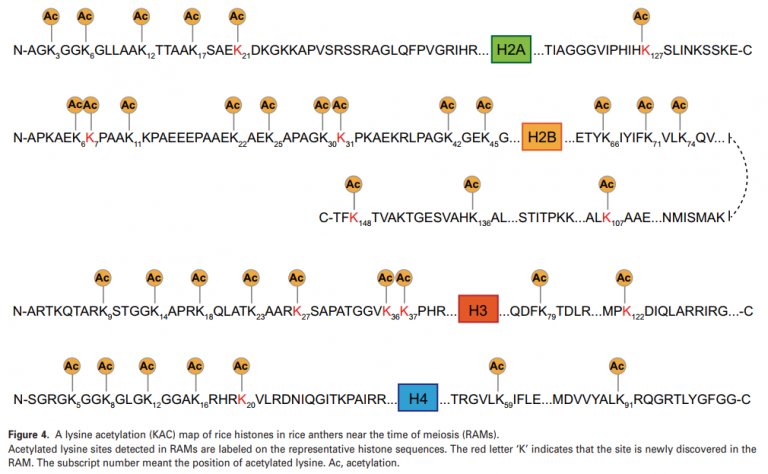
在本文中,一共检测到79个与组蛋白匹配的独特的赖氨酸乙酰化肽,揭示了最多143个赖氨酸位点。其中,47个乙酰化肽有一个乙酰化赖氨酸位点,27个含有两个位点,5个拥有三个位点。这些数据表明,在RAM发育过程中,组蛋白中多个赖氨酸位点同时发生乙酰化。通过与水稻中可用赖氨酸乙酰化位点的比较,在RAM中发现了28个新发现的组蛋白乙酰化位点,极大地扩展了水稻组蛋白乙酰化图谱(图4)。
在水稻中,H3K9乙酰化在雄性减数分裂过程中普遍减少。在水稻中,H3K9乙酰化在雄性减数分裂过程中明显降低。此外,H4K12和H4K16乙酰化分别与人类和小鼠的减数分裂染色体分离和着丝点功能有关。同时在本文中的RAM数据中所有这些乙酰化位点都得到了确认,这增强了研究组蛋白乙酰化在植物减数分裂中的作用的必要性。
5. 水稻减数分裂相关非组蛋白的赖氨酸乙酰化
减数分裂在真核生物有性生殖中起着至关重要的作用,产生单倍体配子。同源配对、突触、重组和染色体分离是减数分裂的关键过程。
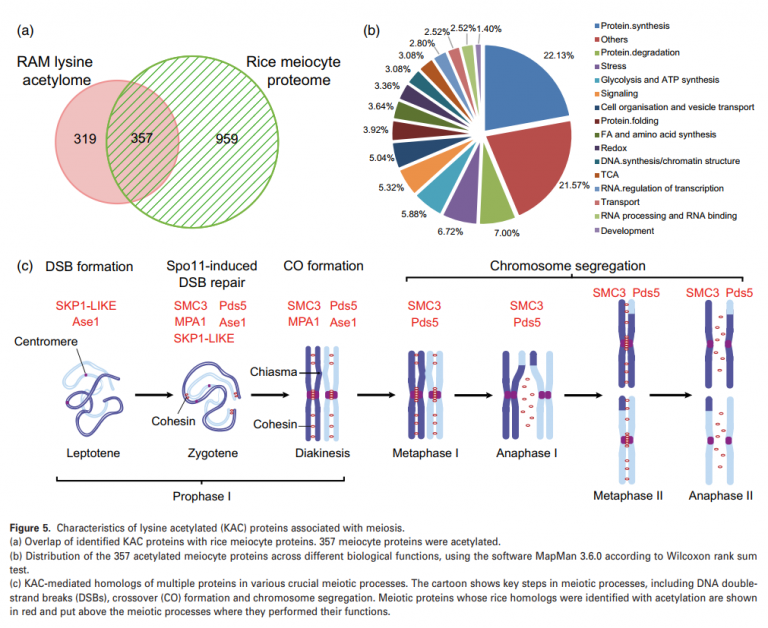
作者通过先前报道的水稻减数细胞蛋白组和RAM赖氨酸乙酰化组进行比较分析潜在的参与水稻减数分裂的KAC蛋白发现,在RAM中鉴定的总蛋白中,有超过一半的357个乙酰化蛋白存在于水稻的减数分裂细胞中(图5A)。通过这些乙酰化的减数细胞蛋白的MapMan分析表明,它们在DNA合成/染色质结构、蛋白质降解和折叠、RNA处理和转录调控、细胞组织和囊泡运输等方面都丰富的含量(图5B)。在该研究数据中总共发现了8个水稻减数分裂蛋白同源物(图5C)。其中4个水稻蛋白是拟南芥减数分裂蛋白的同源蛋白,包括skp1样蛋白、MPA1蛋白和SMC3蛋白。另外四个是酵母减数分裂蛋白的同源物:Yng2p、Rfc5、Pds5和Ase1。
同时发现在SMC3水稻同源物中,相邻的两个赖氨酸残基(K105和K106)在同一肽段中乙酰化,这为SMC3在体内的双乙酰化状态提供了直接证据。蛋白质序列比对分析显示,K105和K106在水稻、玉米、拟南芥、人类、小鼠和酵母中高度保守,表明这些残基的乙酰化及其在调控SMC3中的作用可能具有进化保守性。水稻有两个ECO1同源基因,LOC_Os05 g31230和LOC_Os04 g42120,在蛋白质序列水平上有98%的同源性,表明它们之间存在功能冗余。
6. 赖氨酸乙酰化调节水稻绒毡层代谢
蛋白质KAC调节细胞代谢状态,特别是影响人类葡萄糖、氨基酸和脂肪酸代谢的重要酶。
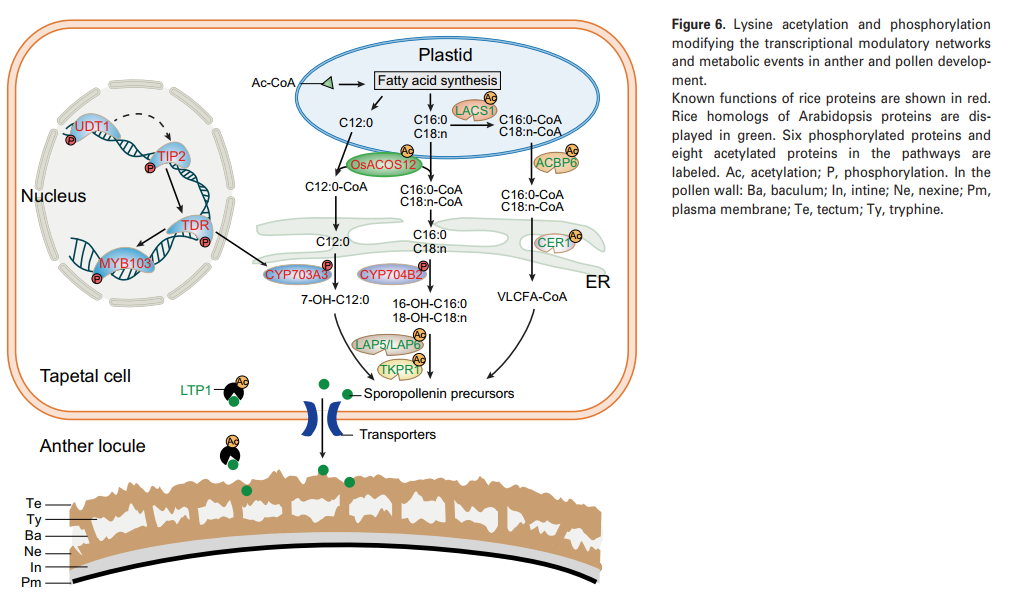
在本文中,RAM赖氨酸乙酰体从14个非冗余乙酰化肽中鉴定了14个赖氨酸乙酰化位点,包括四个已知的水稻绒毡层和花粉发育蛋白(图6)。 这些蛋白质分别对孢子粉生物合成(OsACOS12)、花粉内发育(OsUAM3)和愈伤组织沉积(OsUGP1)至关重要。同时发现OsUGP1有9个赖氨酸乙酰化位点,为愈伤组织代谢中蛋白质的多个赖氨酸修饰提供了直接证据。 为了了解其他检测到的KAC位点是否存在于水稻中潜在的绒毡层相关蛋白中,作者在拟南芥中寻找已知绒毡层和花粉发育基因的水稻同源性。 在赖氨酸乙酰体中发现了13个拟南芥蛋白质的15个水稻同源物,揭示了另外20个潜在影响花药和花粉发育的蛋白质乙酰化位点(图6)。在已知的参与绒毡层和花粉发育的功能蛋白中,发现有8种是乙酰化的。其中6种蛋白质被磷酸化,包括4种作为转录因子的功能(OsUDT1、OsTIP2、Os TDR和OsMYB103)和2种(CYP703A3和CYP704B2)作为酶(图6)。
分泌蛋白通过参与各种代谢事件在花药/花粉发育中起重要作用。在该研究中,47个由信号P和目标P预测的RAM分泌蛋白被乙酰化。 其中9种蛋白质仅在水稻绒毡层中表达。 在人类结肠癌细胞中,一项研究表明,GRP78的分泌受到KAC的调节。 有趣的是,人类GRP78的水稻同系物LOC_Os02G02410在该研究中的六个赖氨酸位点被乙酰化。
7.RAM中蛋白质乙酰化与磷酸化的关系
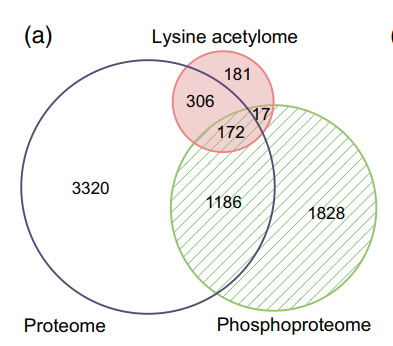
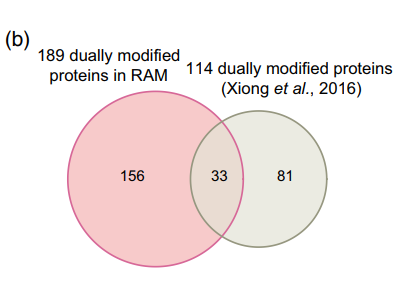
作者先前报道的相同RAM中的磷酸化蛋白质组学数据与本文乙酰化蛋白质组学数据进行比较分析,发现189个蛋白质也被乙酰化(图7A),为KAC与磷酸化在调节水稻花药发育和减数分裂中的潜在相关性提供了证据。 通过GO富集分析阐明这些双修饰蛋白的生物学功能,在生物过程类别中,核小体组装、糖酵解过程、翻译起始、镉离子响应和热基团响应显著富集。 KEGG途径富集分析发现这些蛋白参与糖酵解/糖异生、碳固定、ER中的蛋白质加工、RNA降解、核糖体和内吞作用。 同时发现181个乙酰化蛋白完全存在于RAM赖氨酸乙酰体中。 另外与先前检测到的114个双修饰蛋白的比较表明,该文RAM数据中的156个蛋白质是新的(图7B)。
作者将357个减数分裂细胞表达的KAC蛋白(图5A)与156个双修饰蛋白(图7B)进行比较分析,发现103个蛋白质重叠,这意味着KAC与磷酸化之间的相关性可能影响水稻减数分裂;同时作者对蛋白质-蛋白质相互作用网络进行了生物信息学分析,以确定KAC蛋白之间可能的节点和相互作用,发现该网络在关键枢纽处包含许多双修饰蛋白。 例如参与核糖体组装/翻译、ER中的蛋白质处理、RNA运输、糖酵解/糖异生作用、蛋白酶体、RNA降解和内吞作用。在这个相互作用网络中,超过半数的蛋白具有比乙酰化更多的磷酸化位点,而ER中在糖代谢和蛋白加工的富集途径中下降的蛋白具有更多的KAC位点。
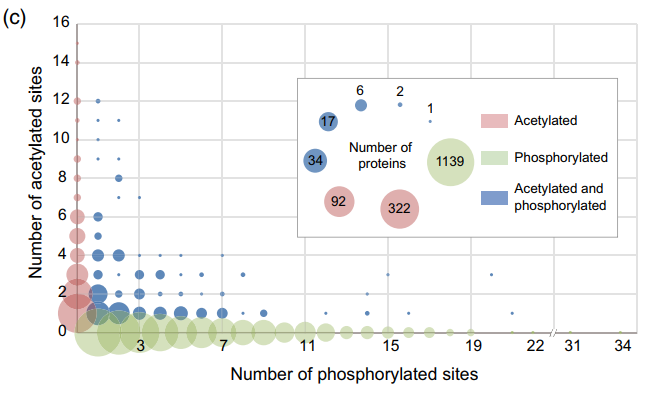
蛋白PTMs常发生在特定蛋白的近距离位点,导致功能调节或信号转导。在本研究中发现,在35个蛋白质中,许多乙酰化和磷酸化位点的位置非常接近(相距10个氨基酸残基或更少)。例如,烯醇化酶蛋白(LOC_Os10 g08550)在K324位点发生乙酰化,在S325位点发生磷酸化。同时鉴定了另一种蛋白,LOC_Os08 g27070,注释为伴随蛋白SBA1,具有乙酰化位点(K202)和磷酸化位点(S203)。还在四个蛋白(LOC_Os04 g47220中的K14和S16)中观察到邻近的乙酰化和磷酸化位点;LOC_Os01 g70020中的K358和S360; LOC_Os03 g40010中的S570和K572;LOC_Os03 g51470中的K81和S83。对于仅通过磷酸化或KAC修饰的蛋白,蛋白数量与修饰位点数量呈负相关。然而,对于双重修饰的蛋白,上述关系呈现复杂的模式(图7C)。