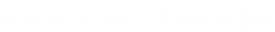Glycosy糖基化蛋白组
蛋白质是生物学功能行使的直接参与者,机体内的生命活动广泛涉及糖基化修饰的蛋白质。糖基化蛋白质功能的实现依赖于糖侧链,蛋白的糖链被细胞表面识别蛋白识别并与之结合,进而发挥其功能,因此,糖修饰是其发挥生物功能不可或缺的。生命系统内大量的生命活动中有超过一半的蛋白质在行使功能时进行了糖基化修饰。这些生命活动包括淋巴细胞激活与调亡、抗原识别与清除、细胞粘附、信号传递和内吞作用等过程。

由于在结构上,糖基化修饰具有宏观不均一性(一个蛋白质上有多个糖基化位 点,甚至是不同类型的糖基化位点)和微观不均一性(同一糖基化位点上可以连接 不同类型的多糖),糖基化修饰研究相较于其他修饰更加困难。根据连接氨基酸残基不同,糖基化主要分为 N-糖基化(可细分为高甘露糖型、复合型、杂合型)、O-糖基化(研究比较多的是 O-GalNAc、O-GlcNAc)、C-连接糖基化、糖基磷脂酰肌醇(GPI)锚四大类型。不同的修饰类型功能有所不同,其中研究最 多的是 N-糖基化,O-糖基化次之。
N糖修饰 O糖修饰 修饰富集 技术流程 产品信息 案例解读
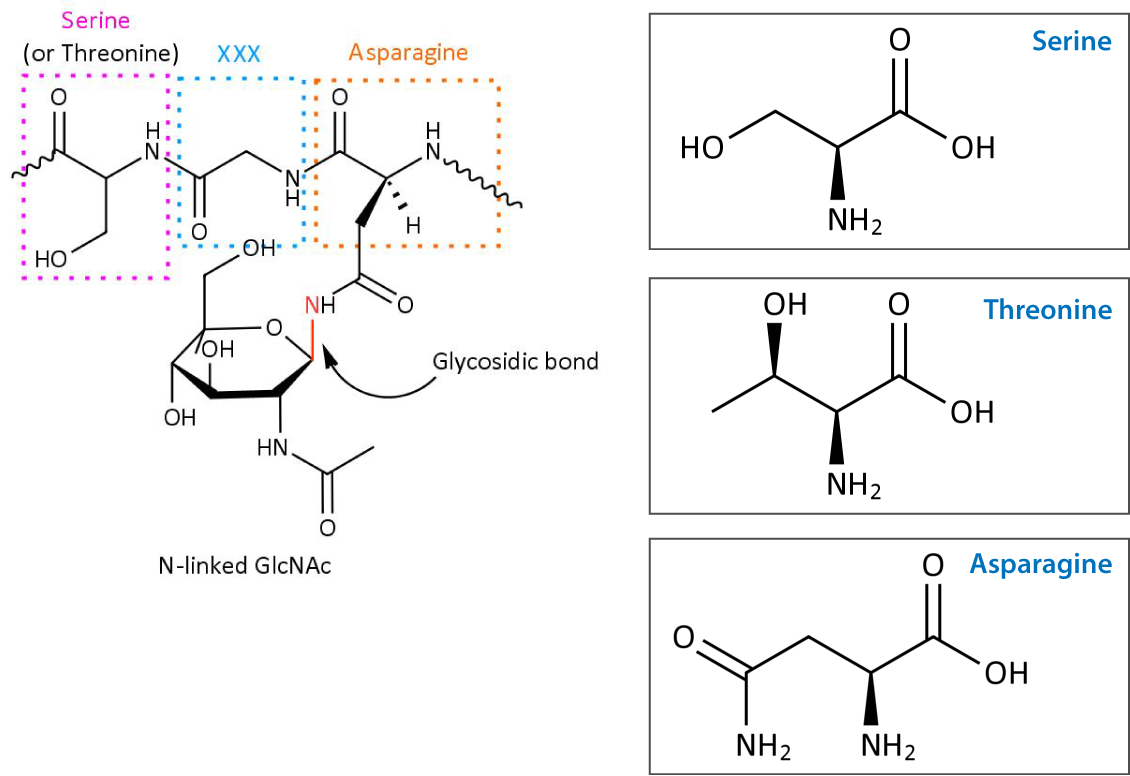
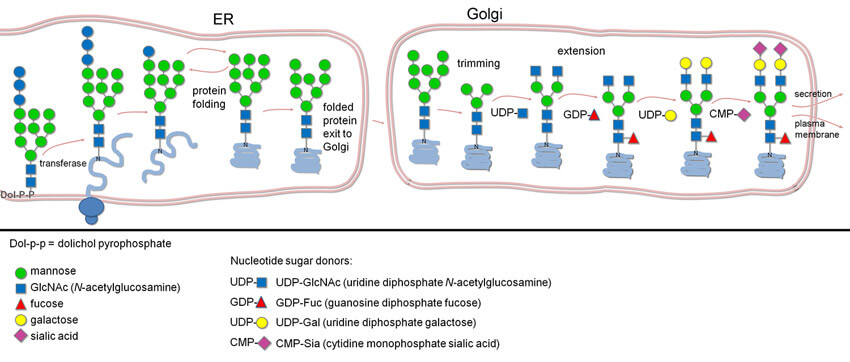
N-连接糖基化(N-linked glycosylation) 是一种新生肽链的共翻译或翻译后修饰方式,糖链通过与新生肽链中特定天冬酰胺(N-X-S/T,X≠P)的自由-NH2 基连接,所以将这种糖基化称为N-连接的糖基化。N-糖基化的过程在内质网和高尔基体中进行。N-糖基化修饰主要包括 N-糖的合成、转移和修饰三个过程。 N-糖的合成和转移在内质网中进行,其修饰过程在内质网和高尔基体中都存在。植物和哺乳动物中 N-糖基化修饰存在差异。
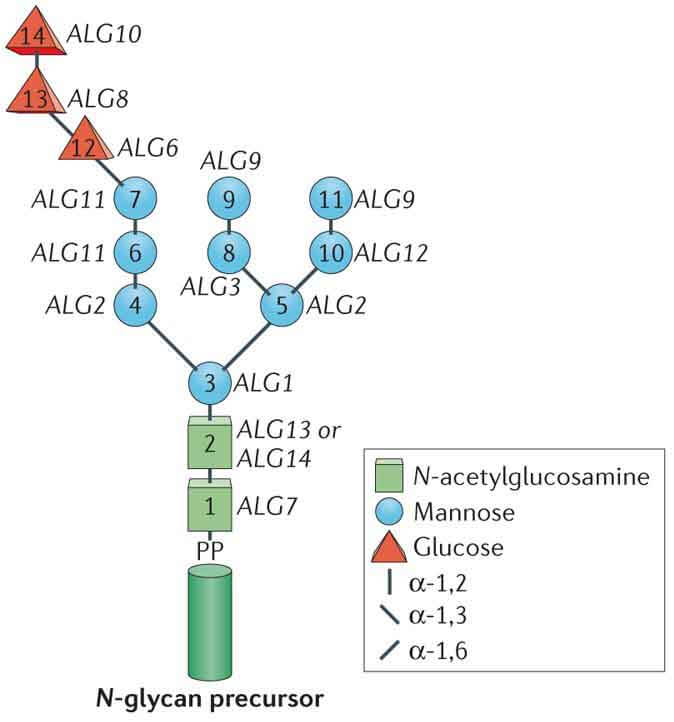
合成:N-糖的合成起始于内质网膜胞质一侧,多萜醇(dolichol)首先经过磷酸化活化,随后在一系列糖基转移酶作用下形成一个具有2分子N-乙酰葡糖胺,9分子甘露糖和3分子葡萄糖的寡糖链,形成三天线结构。
转移:寡糖基转移酶(oligosaccharyltransferase,OST)复合体将合成的寡糖链转移至新生肽链中特定的天冬酰胺(N-X-S/T,X≠P)上 。此天冬酰胺(N) 所在的基序比较保守,天冬酰胺(N)的后一位氨基酸为除脯氨酸(P)以外的任意氨基酸(X),后两位氨基酸主要是丝氨酸(S)与苏氨酸(T),后两位也存在其他氨基酸的可能,不过很少。值得注意的是,并不是所有的 N-X-S/T,X≠P 基序都能发生 N-糖基化修饰。
修饰:进入高尔基体后,原来糖链上的大部分甘露糖被切除,但又由多种糖基转移酶依次加上了不同类型的糖分子,形成了结构各异的寡糖链。植物和哺乳动物中 蛋白质的 N-糖基化模式不同,其差异主要出现在高尔基体阶段。根据五糖核心外围糖链的延长方式不同,N-糖基化修饰常分为三种类型:高甘露糖型、杂合型与复合型。
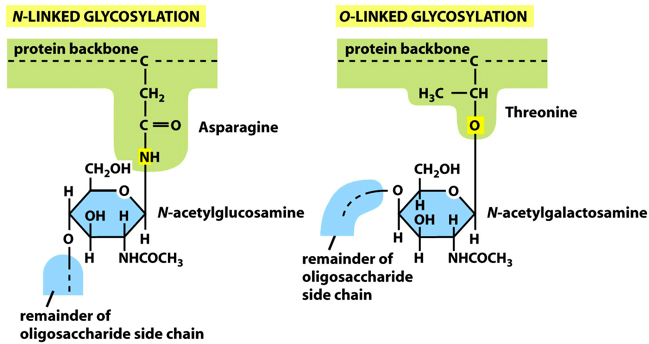
蛋白质O-糖基化发生在蛋白质丝氨酸或苏氨酸残基的羟基氧原子上。O-连接氮乙酰半乳糖胺修饰(O-GalNAc)和O-连接氮乙酰葡糖胺修饰(O-GlcNAc)是两种重要的O-糖基化。
O-GalNAc糖基化反应由多肽GalNAc转移酶(ppGalNAc-Ts)催化起始,在其他特异性糖基转移酶催化下继续延伸,生成含有分枝O-连接复杂聚糖结构。
O-GlcNAc糖基化则是在O-GlcNAc糖基转移酶(OGT)催化下,利用UDP-GlcNAc为底物糖供体,将GlcNAc共价连接到蛋白质的丝/苏氨酸残基上的一种动态可逆单糖修饰。这两种O-糖基化修饰底物分布广泛,功能各异,参与调节了几乎所有重要生理过程和重大疾病的发生发展。O-GlcNAc常发生在细胞核与细胞质中,是一种重要的细胞内信号调控方式,常与磷酸化位点重叠,从而与磷酸化形成cross-talk。O-GalNac糖基化修饰最初主要发现存在于黏液和免疫球蛋白中,因此也常被称为黏蛋白糖基化。
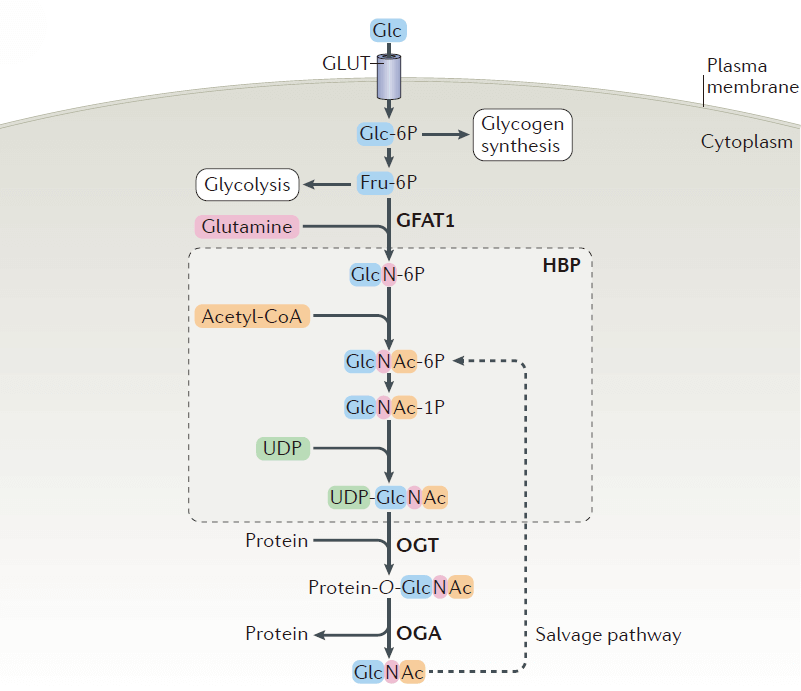
O-GlcNAc糖基化是通过己糖胺生物合成途径(HBP)生成,该过程汇合了葡萄糖、氨基酸、脂肪酸和核苷酸代谢,产生出O-GlcNAcylation的供体-尿苷二磷酸-N-乙酰葡糖胺(UDP-GlcNAc)。最新的研究发现,除了营养物质的丰度外,O-GlcNAc信号通路还对各种形式的细胞应激(热休克、缺氧和营养缺失等)高度敏感。因此,有人将O-GlcNAcylation比作营养和压力的传感器,进而调节转录、翻译、信号转导和代谢等细胞活动。在生理上,O-GlcNAcylation体内平衡的破坏涉及许多人类疾病的发病机理,包括癌症、糖尿病和神经变性。证据表明O-GlcNAcylation与其他蛋白质修饰发生复杂的相互作用。其他蛋白质修饰通常是由多种 “writers” 和“erasers”调节,目前的研究表明可逆的O-GlcNAcylation修饰由一对酶控制:N-乙酰氨基葡萄糖转移酶(OGT)和O-连接的N-乙酰葡糖胺水解酶(OGA),OGT将供体UDP-GlcNAc的GlcNAc转移目的蛋白的丝氨酸和苏氨酸残基的羟基上, OGA负责将GlcNAc移除。
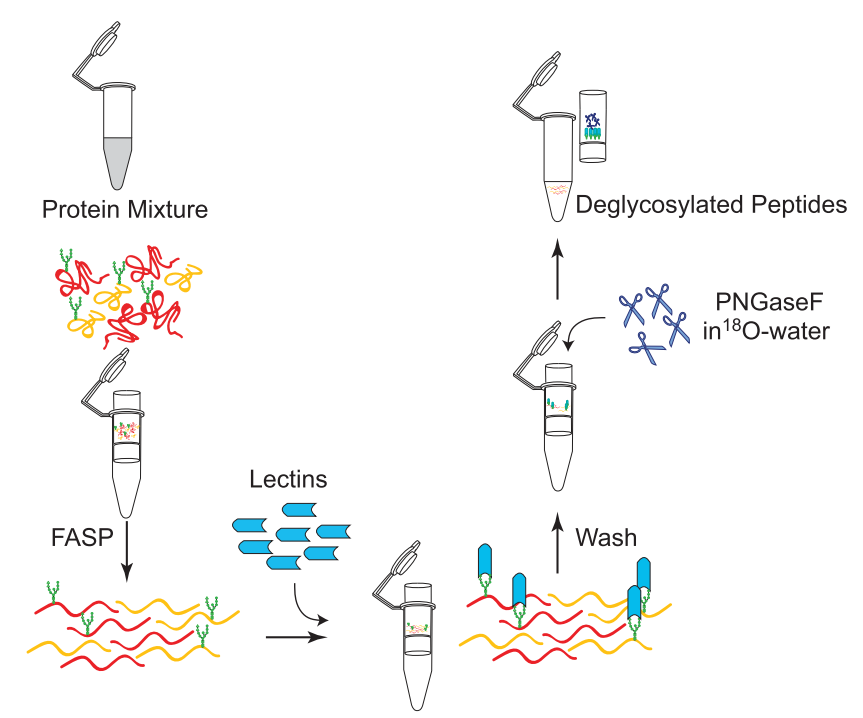
N-糖基修饰肽段富集:
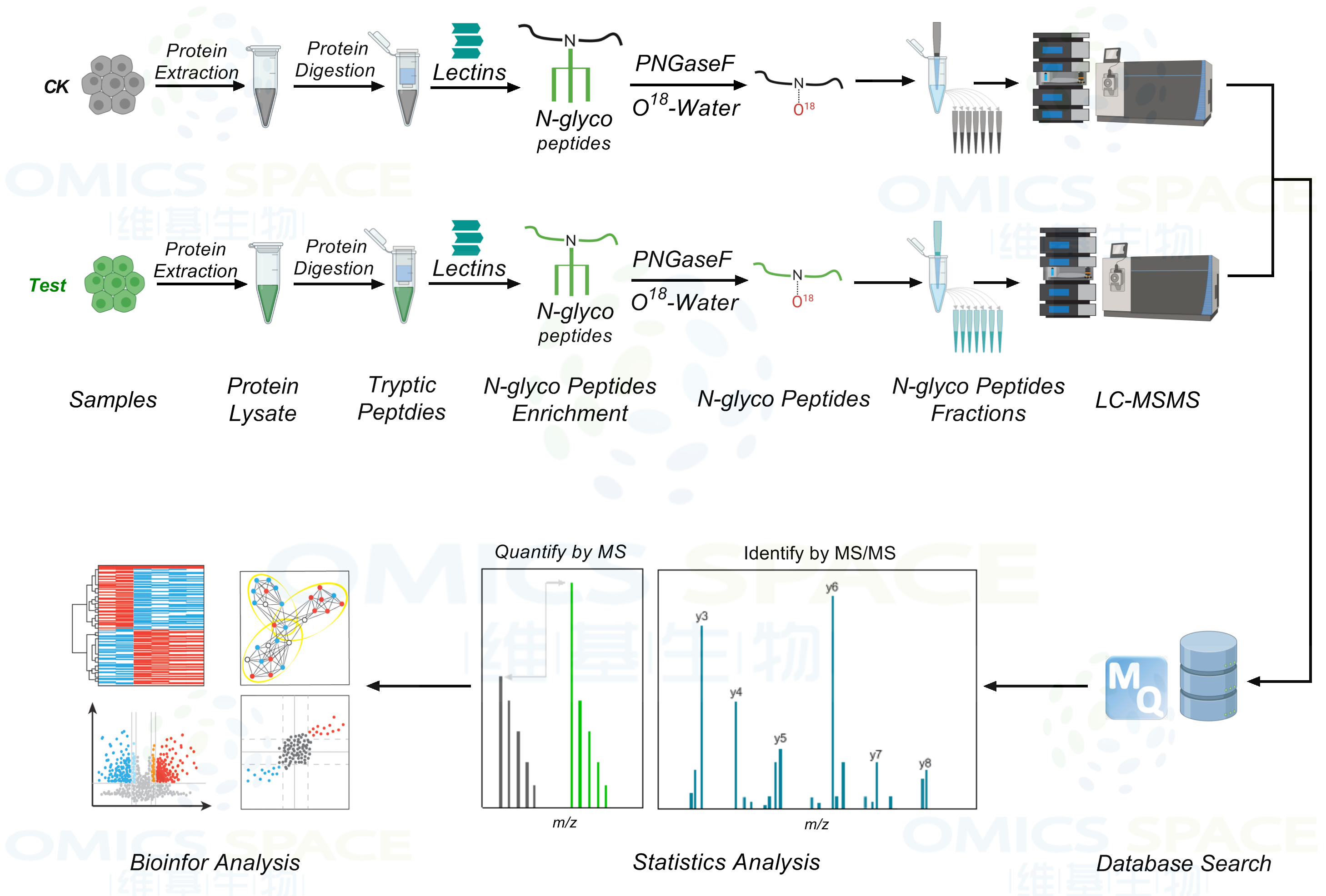
一般发生N-糖基化位点修饰的蛋白,都有基本的氨基酸结构骨架,为N-X-S/T(X是除了P之外的氨基酸)。为了鉴定N-糖基化修饰位点,首先用蛋白酶酶解蛋白,再通过凝集素富集N-糖基化修饰肽段,最后用糖苷酶PNGase F在18O水中切除链接在Asn上的糖链,糖链释放过程中糖基化位点处的Asn转变为Asp,产生+2.9890Da的分子量差异,该分子量的变化可通过串联质谱的鉴定而得以发现,从而确定该蛋白质的糖基化位点。
O-糖基修饰肽段富集:
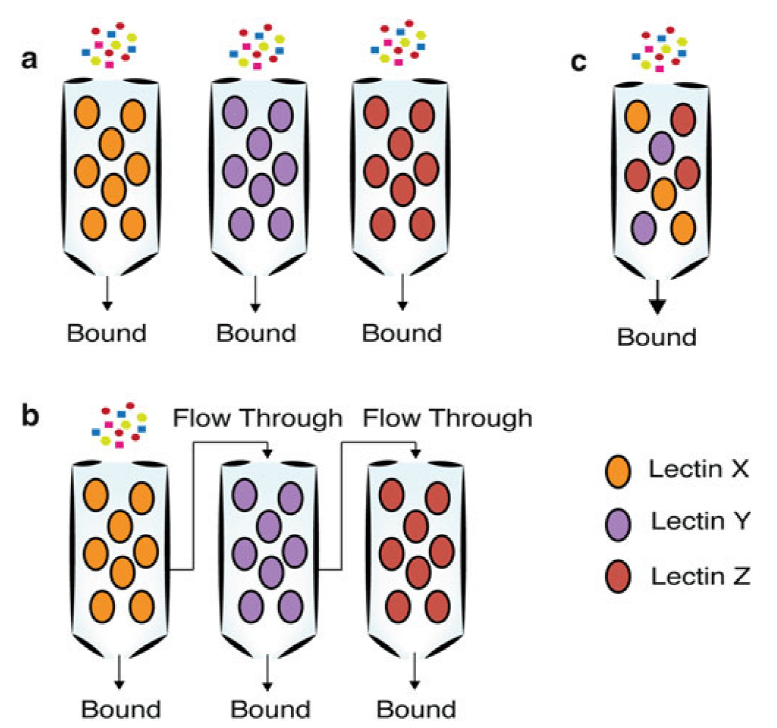
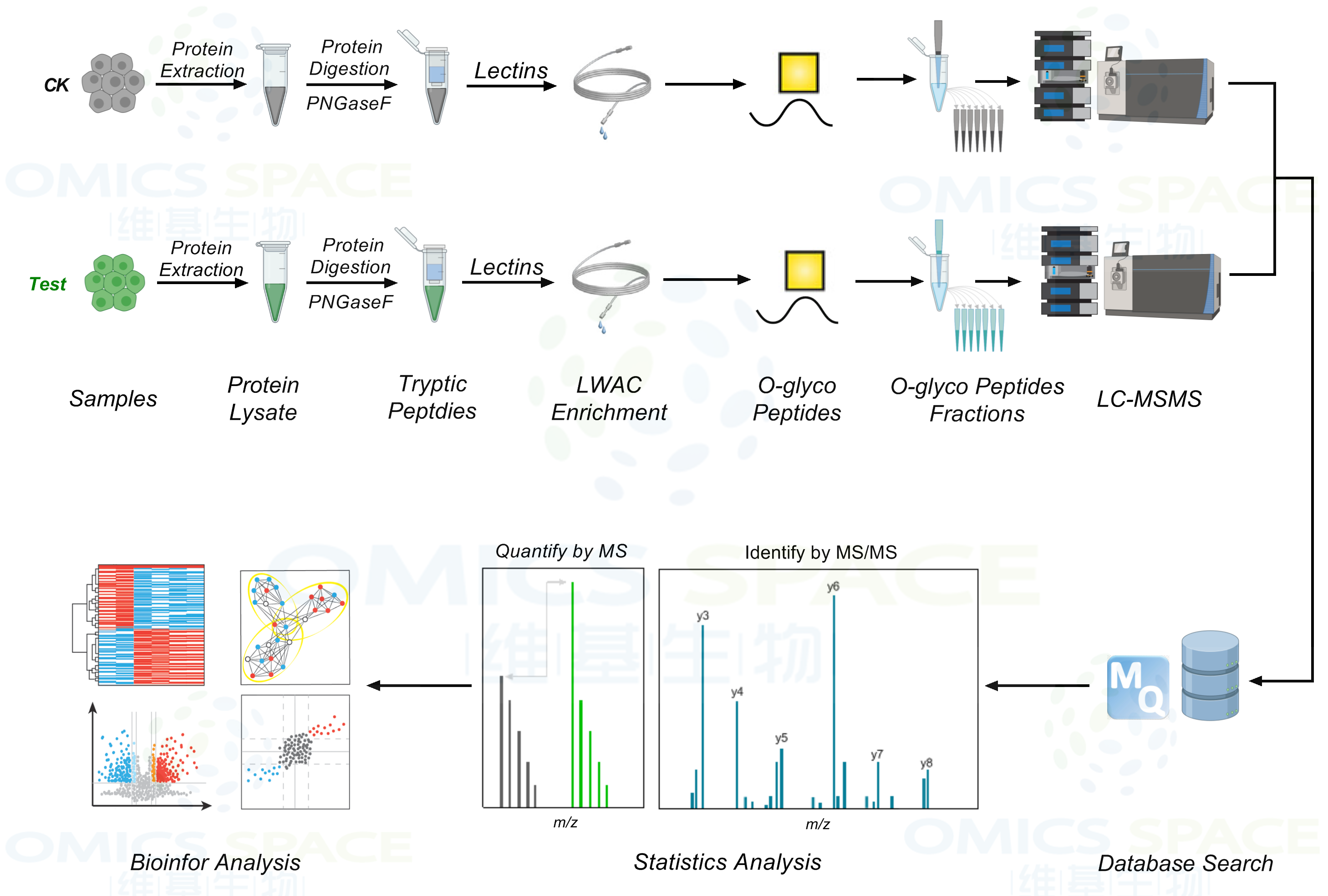
对于蛋白质O糖基化的PTM,采用植物凝集素法进行检测,植物凝集素具有与多种糖类选择性亲合的糖蛋白。目前应用最广泛的检测蛋白质O-GlcNAc糖基化PTM的植物凝集素是麦胚凝集素(wheat germ agglutinin,WGA)。WGA用于蛋白质O-GlcNAc糖基化的PTM检测的优势在于,与末端含有GlcNAc和唾液酸的糖链具有高度亲和性。不同类型的O糖修饰可以选着针对性的凝集素进行富集。
N-糖蛋白质组学:
O-糖蛋白质组学:
1.产品描述:大规N-糖/O-糖修饰蛋白质组学-对客户提供的不同组别的样本进行酰化修饰蛋白质组学分析,鉴定获得所有样本的N-糖/O-糖修饰位点/肽段/蛋白信息,定量筛选不同组别样本之间显著性差异表达的N-糖/O-糖修饰位点,并对相关N-糖/O-糖修饰蛋白进行生物信息学分析。
2.样品要求:
2.1. 常规人、动物组织(比如肝脏、肾脏、脑组织等):≥2g;
2.2. 软体动物:≥2g;
2.3. 动物坚韧组织(软骨、毛发等):≥5g;
2.4. 植物叶片等鲜嫩组织:湿重≥5g;
2.5. 植物富含杂质或蛋白含量低的样本,如植物根,根茎、木质部、韧皮部组织等:干重≥10g;
2.6. 植物花粉:≥400mg;
2.7. 藻类组织:≥5g;
2.8. 细胞样本数目须达到:2*107(建议使用本公司的裂解液进行裂解之后再进行寄送);
2.9. 微生物菌类:≥300µL纯菌体;
2.10. 体液类(唾液、羊水、脑脊液等)10 mL以上,不能溶血;血清500 μl以上;尿液50 mL以上。
2.11. 其他特殊样本如有疑问请联系我们。
3.质谱信息:Orbitrap Fusion(Thermo Scientific),Orbitrap Elite(Thermo Scientific)
4.测试周期:30个工作日
5.报告信息:测试报告、修饰位点/肽段/蛋白质鉴定列表(电子版)、显著性分析列表(电子版)、生物信息学报告、原始质谱测试文件
6:生信分析:
6.1. 质谱数据质量分析
6.2. 显著性差异统计分析
6.3. GeneOntology注释和富集分析
6.4. KEGG注释和富集分析
6.5. 蛋白质互做网络PPI分析
6.6. 蛋白修饰PTM分析