技术文档
血清蛋白质组学分析流程
 人体血液是很容易获取的实验材料,用于检测发现生物标志物,来诊断和监视疾病的发展。血液普遍存在于身体里,为细胞和组织提供能量和清除废物。血液样品在临床上很容易获得,但含有像白蛋白这样的高浓度蛋白,在质谱分析中,那些高丰度的蛋白常常会将具有意义的低丰度蛋白掩盖。
人体血液是很容易获取的实验材料,用于检测发现生物标志物,来诊断和监视疾病的发展。血液普遍存在于身体里,为细胞和组织提供能量和清除废物。血液样品在临床上很容易获得,但含有像白蛋白这样的高浓度蛋白,在质谱分析中,那些高丰度的蛋白常常会将具有意义的低丰度蛋白掩盖。
Dayon和Kussman比较基于质谱的不同血浆处理流程,来进行质谱检测,提供了一个可供参考的分析,关于每一个样品所花费的时间、步骤、结果和检测范围。他们分析了一个带有商业性质的合并人血浆样品,采用三种不同的LC-MS/MS工作流程,研究者们比较原始样品与去丰度样品,非标记和标记的不同定量结果。
简单来说,三种方法制备样品的实验流程如下:
· 没有经过去高丰度处理直接进行LC-MS/MS实验。
· 经过一次去高丰度处理后进行LC-MS/MS实验。
· 经过连续两次去高丰度处理后进行LC-MS/MS实验。
首先,研究者用商品化试剂盒对样品进行免疫去除,去除血浆样品中超过99%的20种高丰度蛋白,下一步过夜酶解,一半的酶解样品进行6标TMT试剂标记,一半样品非标记,然后进行Orbitrap LC-MS,配合纳升超高效液相色谱仪和 UltiMate 3000 RSLC纳升级液相色谱做预备分析。
研究者们发现经过一次去高丰度处理可以去除血浆样品中85%的高丰度蛋白,连续两次去高丰度处理可以去除95%的高丰度蛋白。该小组随后用1D-RP(反相)-LC-MS/MS,进行70mins(15cm柱子)和150mins(50cm柱子)的分离,用2D-RP/RP-LC-MS/MS分析样品,但由于没有足够的体积,没有使用2D-RP/RP-LC-MS/MS双重处理样品。
该小组在DDA-MS/MS模型中用混合线性离子阱谱仪进行非标记定量,通过用TMT标记质谱峰图上10个最强烈的峰,进一步用CID和HCD进行破碎。
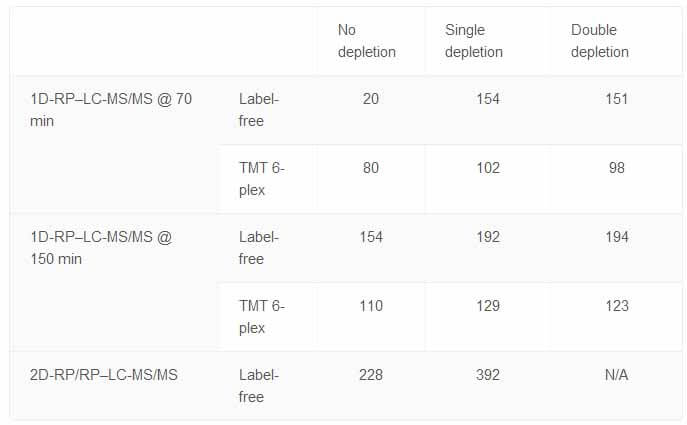
如表1所示,研究者们获得了蛋白质检测范围的较好实验结果,在进行LC-MS/MS分析前,用免疫耗竭方法处理样品,通过双重处理,更多特有的蛋白质被检测到。该小组发现最有效的实验流程是单重处理样品,再进行RP-LC 150mins分离相(大约一个样品需3小时)。虽然2D-RP/RP-LC-MS/MS能得到最好的蛋白检测范围,但是每个样品需要长达20h的检测时间影响了其优势。
Table 1. Number of proteins identified with each workflow
重复的比较每一个流程,Dayon 和Kussman计算出每个样品的实验变异率应小于5%,作者提出要调整上面描述的实验流程,并批判性的评估实验数据,来进一步探索自动化分析血浆蛋白质组学。(作者:3D group)
Reference
1.Dayon, L., and Kussmann, M. (2013) “Proteomics of human plasma: A critical comparison of analytical workflows in terms of effort, throughput and outcome,” EuPA Open Proteomics, 1(pp. 8–16), Doi: 10.1016/j.euprot.2013.08.001.