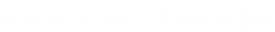文献解读
项目文章|新孢子虫分泌的细胞外囊泡被TLR2识别并通过MAPK信号通路调节宿主细胞的天然免疫力-Frontiers in Immunology -201807
新孢子虫是专性的细胞内寄生虫,在牛业中造成重大的经济损失。但是,关于寄生虫与宿主相互作用的免疫机制尚未完全了解。细胞外囊泡(EVs)已作为一种普遍存在的机制出现,几乎所有细胞,尤其是免疫细胞和肿瘤细胞,都参与细胞间通讯。尽管研究表明弓形虫或布氏锥虫分泌的细胞外囊泡促进了对宿主-寄生虫相互作用至关重要的生物分子的交换,但是,细胞外囊泡及其在新孢子虫中的生物学活性尚不清楚。在这里,作者使用多种方法(包括电子显微镜,纳米颗粒跟踪分析,RT-PCR,免疫荧光,蛋白质印迹,蛋白质组学和细胞因子分析)来检查新孢子虫细胞外囊泡的特性。

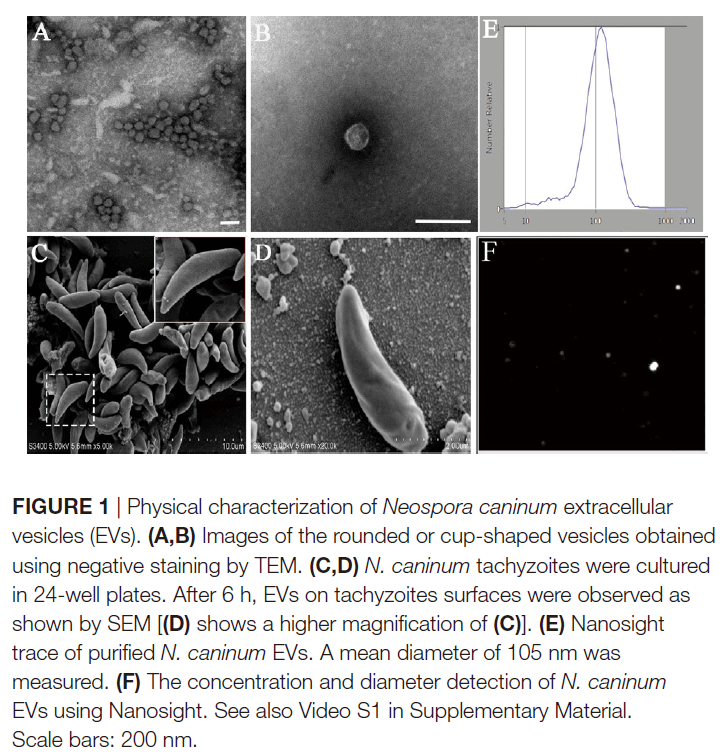
为了测试新孢子虫是否产生细胞外囊泡,通过超速离心法从寄生虫生长培养基中分离出囊泡。纯化的囊泡通过TEM进行负染色观察,显示这些囊泡是圆形或杯状的,被双层膜限制,直径约为50-150 nm(图1A,B)。在24孔板中培养6小时的新孢子虫速殖子的SEM显示,其表面上存在胞外囊泡(图1C,D)。作者使用纳米粒子跟踪分析来直接检查数百万个囊泡,来确定细胞外囊泡的大小。结果表明,EVs的平均直径为105nm,大部分的尺寸在50至150nm之间(图1E,F)。TEM结果显示新孢子虫中存在多囊体状结构(图2D,E)。图2显示了新孢子虫胞外囊泡的双层边界膜。每个面板以两个放大倍数显示。
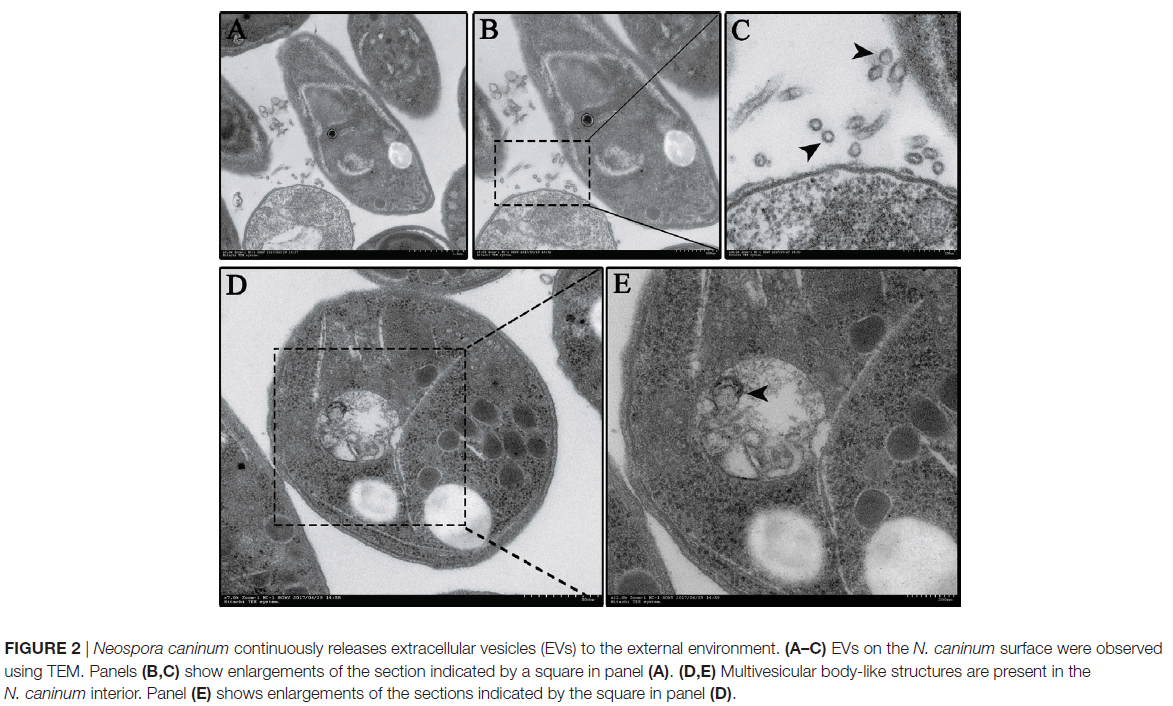
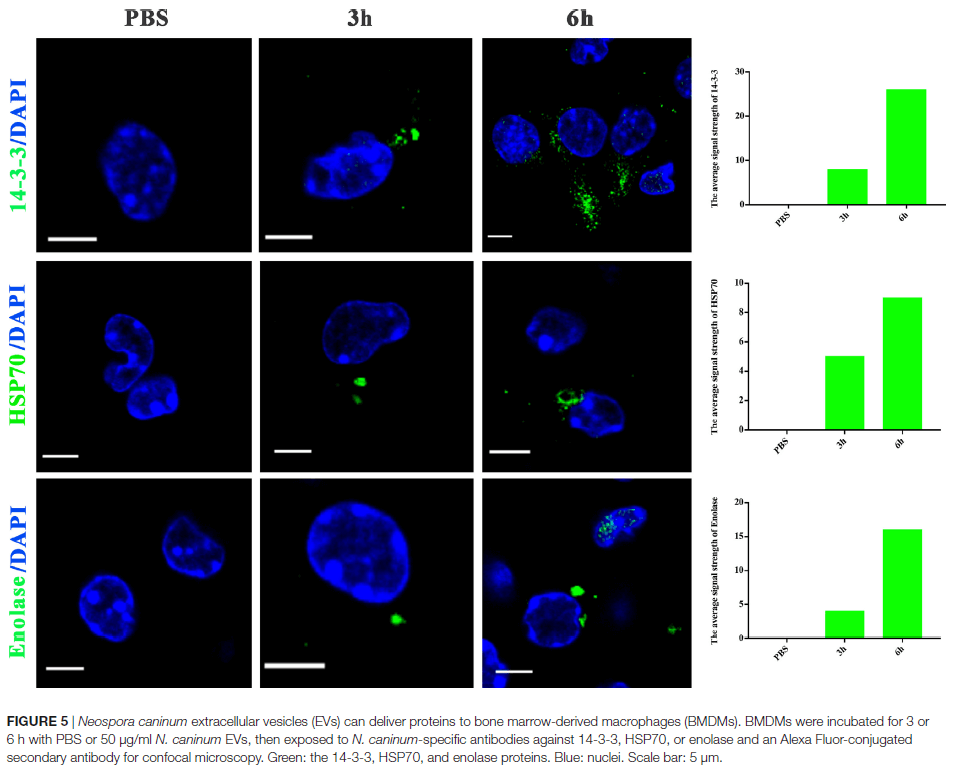
蛋白质组学结果显示,在新孢子虫分泌的EVs中鉴定出705种蛋白质,其中至少有两条特异性肽段检测到65.5%(462/705)。在这些蛋白质中,有556种被分为97种途径,其中前5位是核糖体,碳代谢,剪接体,RNA转运和蛋白酶体,这些途径还包括PI3K-Akt信号通路,MAPK信号通路,NOD样受体信号通路。与ExoCarta中的外泌体蛋白进行比较后,发现其与其他原生动物寄生虫(如阴道毛滴虫,多房棘球绦虫和利什曼原虫)广泛重叠。使用14-3-3, HSP70和烯醇酶抗体鉴定胞外囊泡的结果如图3A,与生物过程,细胞成分和分子功能有关的新孢子虫EVs基因的百分比如图3B。囊泡中的蛋白质,尤其是分子量为30–50kDa的蛋白,被小鼠新孢子虫血清抗体特异性识别(图3C),这表明新孢子虫囊泡参与诱导宿主细胞的免疫反应。
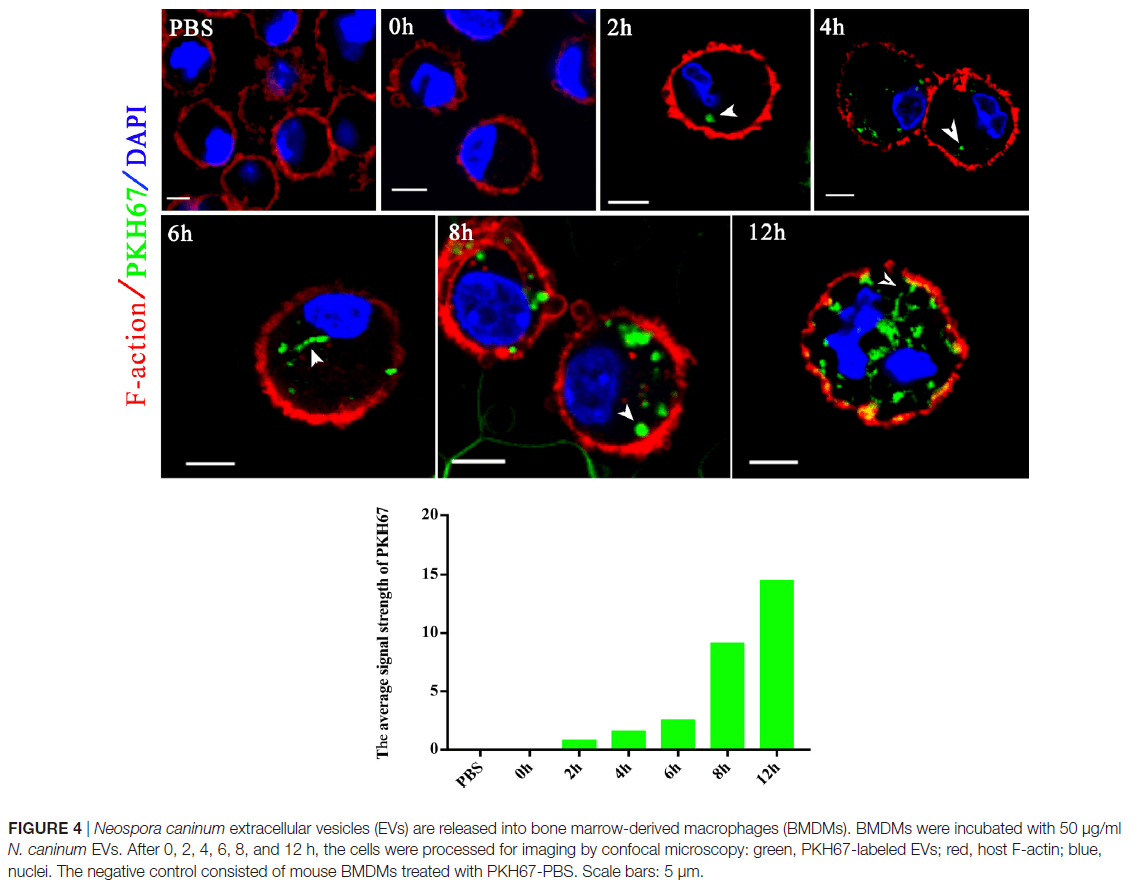
胞外囊泡可以将分子从病原体转运到宿主,并可以转移抗原和传染因子。以前,保外囊泡被认为是将利什曼原虫分子直接递送到巨噬细胞和调节免疫反应的一种机制。作业也假设新孢子虫胞外囊泡可以将新孢子虫分子直接运送到巨噬细胞中。用绿色荧光脂质染料PKH67在体外标记了50μg新孢子虫胞外囊泡,并在不同时间通过共聚焦显微镜检查了骨髓巨噬细胞(BMDM),如图4所示。在新孢子虫胞外囊泡处理后的2h后,BMDM的细胞质中发现了绿色荧光,并且在2h以后的时间点,荧光强度稳定增加。这表新孢子虫EVs被暴露的宿主细胞内在化。通过共聚焦显微镜,在新孢子虫EVs处理后,在受感染的BMDM的细胞质中地观察到荧光,而在PBS处理组中未观察到荧光,进一步确定新孢子虫EVs可以将其内含物传送至BMDM(图5)。
LAL分析显示新孢子虫EVs中,裂解液抗原(NLA)和排泄性分泌抗原(ESA)不能诱导TLR2/TLR4激活或IL-8或TNF-α的产生。作者假设新孢子虫EVs可能会调节BMDM的细胞因子表达,然后研究了炎性细胞因子IL-12p40,TNF-α,IL-1β,IL-6,IFN-γ和IL-10,由BMDM在8、12和24小时后响应新孢子虫EVs分泌。与PBS组相比,用新孢子虫EVs处理的BMDMs中IL-12p40,TNF-α,IL-1β,IL-6,IFN-γ和IL-10的水平显著增加(图 6)。

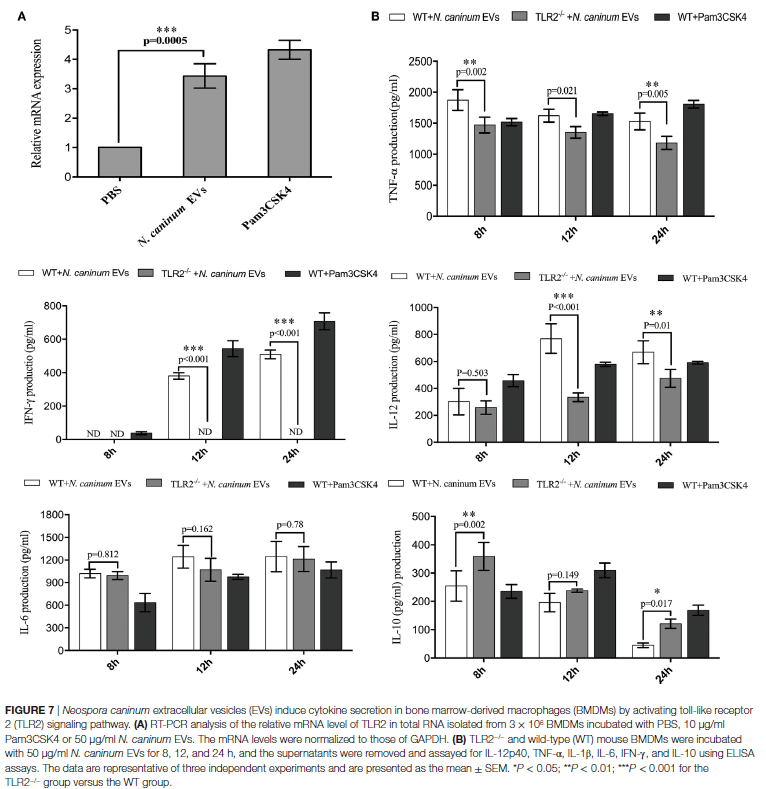
活的新孢子虫速殖子可以诱导TLR2上调并调节炎症细胞因子的产生来控制新孢子虫的感染,但是该过程中涉及的PAMPs和向BMDM呈递抗原的机制仍不清楚。作者将BMDM与新孢子虫EVs孵育12小时,与阴性对照细胞相比,TLR2明显上调(图7A)。为了直接检查TLR2在新孢子虫EVs处理过程中细胞因子产生的作用,将WT和TLR2-/-小鼠产生的BMDM的培养上清液与不加入新孢子虫EVs孵育8、12和24小时后进行检测。发现,与野生型小鼠的BMDM相比,TLR2-/-暴露于新孢子虫EVs的BMDM中IL-12p40,TNF-α和IFN-γ的分泌大大下调,还观察到IL-10也上调(图7B)。
使用WB和磷酸化特异性抗体检查了MAPK信号主要成分,发现新孢子虫EVs处理30分钟后可诱导P38,ERK和JNK明显磷酸化,并且所示时间内逐渐降低,但p-JNK在120分钟时并未降低(图8A,B)。作者推测新孢子虫EVs包含一些抗原成分,在BMDM刺激后可以激活MAPK。作者还研究了新孢子虫速殖子(MOI = 3:1,寄生虫:细胞)和新孢子虫的多肽(NLA,ESA)对BMDMs中MAPK活化的影响。结果表明,所有这些蛋白质在处理30或60分钟后均可诱导p38,ERK和JNK磷酸化(图8A,B)。这些数据表明新孢子虫可能通过其排出/分泌抗原的成分(尤其是新孢子虫EVs中的蛋白)激活了BMDM中的MAPK信号通路。通过TLR2的MAPK信号转导成分,在37°C下用PBS或新孢子虫EVs处理BMDM(WT和TLR2-/-)60分钟。在TLR2-/-细胞中p38,ERK和JNK的磷酸化水平显著降低,这表明新孢子虫EVs通过TLR2诱导了P38,ERK和JNK的磷酸化(图8C,D)。

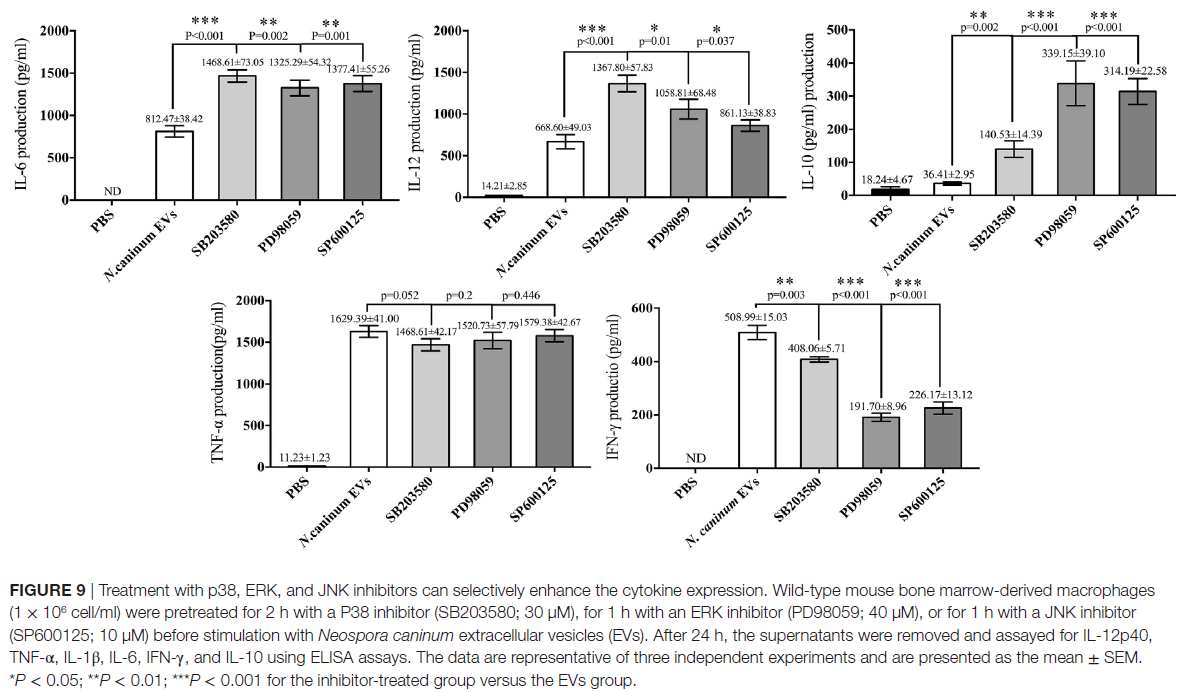
P38,ERK和JNK信号通路在新孢子虫EVs刺激的BMDM中调节TNF-α,IFN-γ,IL-6,IL-12 p40和IL-10表达的作用。 ERK和JNK的活性分别被其抑制剂SB203580,PD98059和SP600125阻断,ELISA分析表明,用抑制剂处理BMDM可以显著增加IL-6,IL-12p40和IL-10的产生。而IFN-γ的分泌显著降低,TNF-α的水平与仅用新孢子虫EVs治疗的BMDM相比没有显著差异(图9)。
这些结果表明,新孢子虫细胞外囊泡可以快速内在化以将蛋白递送至宿主细胞,并以TLR2依赖性方式通过MAPK信号通路调节宿主细胞的免疫应答。首次揭示了新孢子虫细胞外囊泡在寄生虫-宿主相互作用中宿主交流和免疫应答中的潜在作用。