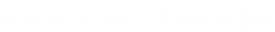文献解读
项目文章|应用化学蛋白质组学揭示CD147为土槿乙酸抑制人癌症细胞功能靶标的分子机制-Chemical Communications-201709
摘要:CD147是一种在多种肿瘤细胞表面高度表达的糖基化跨膜蛋白,在肿瘤的侵袭、发展和转移中起重要作用。我们报道了利用PAB衍生的光亲和探针,通过化学蛋白质组学方法,发现了直接靶向CD147的天然产物假极性酸B(PAB),该探针可作为一种新型抗癌试剂。金钱松(Pseudolaric kaempferi Gordon tree)是从金钱松(Pseudolarix kaempferi Gordon tree)根皮中分离得到的一种天然二萜类化合物,具有较强的抗肿瘤、抗生育、抗病毒和抗真菌等特性。药理学研究表明,金钱松(Pseudolaric kaempferi Gordon tree)在体外可抑制多种人癌细胞的增殖,此外,PAB还通过抑制细胞增殖、侵袭、迁移、粘附和管的形成而显示出显著的抗血管生成作用。在信号水平,PAB干扰NF-kB、MAPK/ERK,PI3K/Akt和p53通路。尽管已经进行了广泛的研究来阐明PAB的深入作用模式,但其多重治疗作用的确切分子机制和蛋白质靶点仍然是难以捉摸的。PAB通过直接与微管蛋白相互作用抑制微管聚合,导致微管失稳,不管准确的结合位点仍然存在争议。然而,抑制微管聚合(B10 mM)的浓度高于大多数癌细胞系(高nM到低mM)的生长抑制浓度,表明其他蛋白质靶点参与了PAB的作用机制。基于活性/亲和性的蛋白质谱分析(ABPP)与定量蛋白质组学相结合已广泛应用于生物活性天然产物的靶点谱分析,光亲和标记是一种在蛋白质变性条件下广泛用于标记非共价结合伙伴的有效方法。

材料:金钱松、
目的:本研究设计了PAB的光活性探针,以在HeLa细胞中全局定位其蛋白质靶点。
实验与结果:
1:PAB通过直接与微管蛋白相互作用抑制微管聚合,导致微管失稳,不管准确的结合位点仍然存在争议。然而,抑制微管聚合(B10 mM)的浓度高于大多数癌细胞系(高nM到低mM)的生长抑制浓度,表明其他蛋白质靶点参与了PAB的作用机制。基于活性/亲和性的蛋白质谱分析(ABPP)与定量蛋白质组学相结合已广泛应用于生物活性天然产物的靶点谱分析,光亲和标记是一种在蛋白质变性条件下广泛用于标记非共价结合伙伴的有效方法。
PAB包含一个独特的聚氢天青烯核,其在结合点处具有反式取代模式,这在任何其他天然产物中都没有发现(图1A)。考虑到非共价结合的可能性,我们设计了一种光亲和探针PAB Dayne,将含有可点击标记的二氮杂碱安装到母体分子上(图1A)。Dead Dayne,一种不含PAB基序的阴性对照探针,也被制备以排除潜在的背景结合蛋白(图1B)。接下来,我们探讨了PAB-Dayne对PAB靶点微管蛋白的标记作用。将纯化的猪脑微管蛋白与PAB-Dayne孵育,紫外线照射,TAMRA-N3反应,凝胶荧光分析。只有PAB-Dayne处理过的微管蛋白在紫外线照射下被标记,并且标记很容易被过量的PAB竞争,表明结合是非共价的但特异的(图1C)。接下来,为了研究化学衍生物是否会影响PAB的抗癌活性,我们评估了探针在HeLa细胞中的抗增殖活性(图1D)。
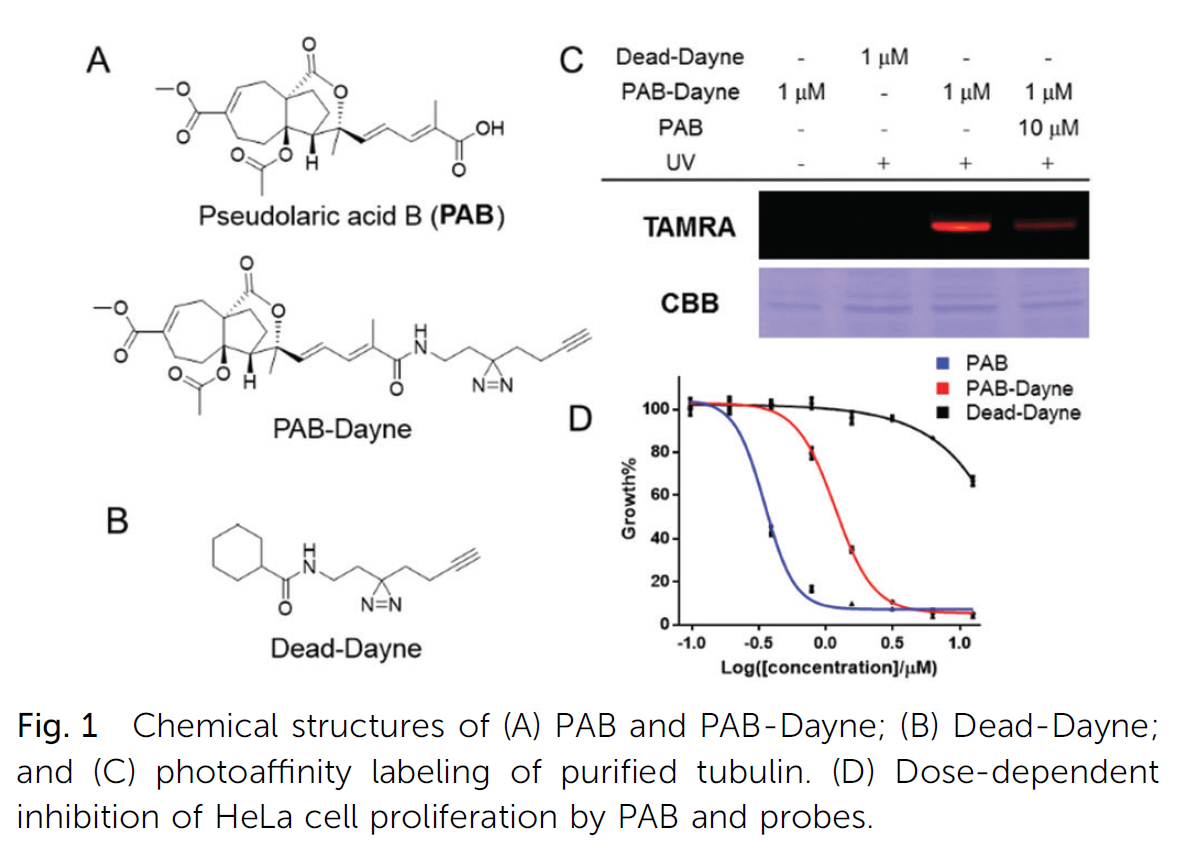
图1:(A)PAB和PAB Dayne;(B)死亡Dayne;(C)纯化微管蛋白的光亲和标记的化学结构。(D) PAB和探针对HeLa细胞增殖的剂量依赖性抑制作用。
结果:在48小时的处理中,3倍浓度的PAB-Dayne足以显示出与PAB-Dayne相同的生长抑制作用,这表明PAB-Dayne保留了PAB-Dayne的生物活性;相反,死亡的Dayne毒性要小得多。
2:为了评估标记特性,HeLa细胞单独或在过量PAB(50 mM)存在下与PAB-Dayne(10 mM)孵育。为了区分光交叉结合蛋白,我们对Dead Dayne进行了相同的平行实验。孵育后,对细胞进行光照、裂解、与TAMRA-N3结合,并通过凝胶荧光分析(图2A)。标记了一个具有更高质量的额外蛋白质的显性B40 kDa带,并且大多数标记的蛋白质都超过了PAB(图2A,3和4通道)。大多数波段的探针标记是紫外依赖的,其中只有少数是光交联结合物(图2A,通道1和2)。此外,在细胞内“咔嚓”一声观察PAB-Dayne的细胞摄取和亚细胞分布。探针处理的细胞经紫外线交联、固定、渗透并点击TAMRA-N3。
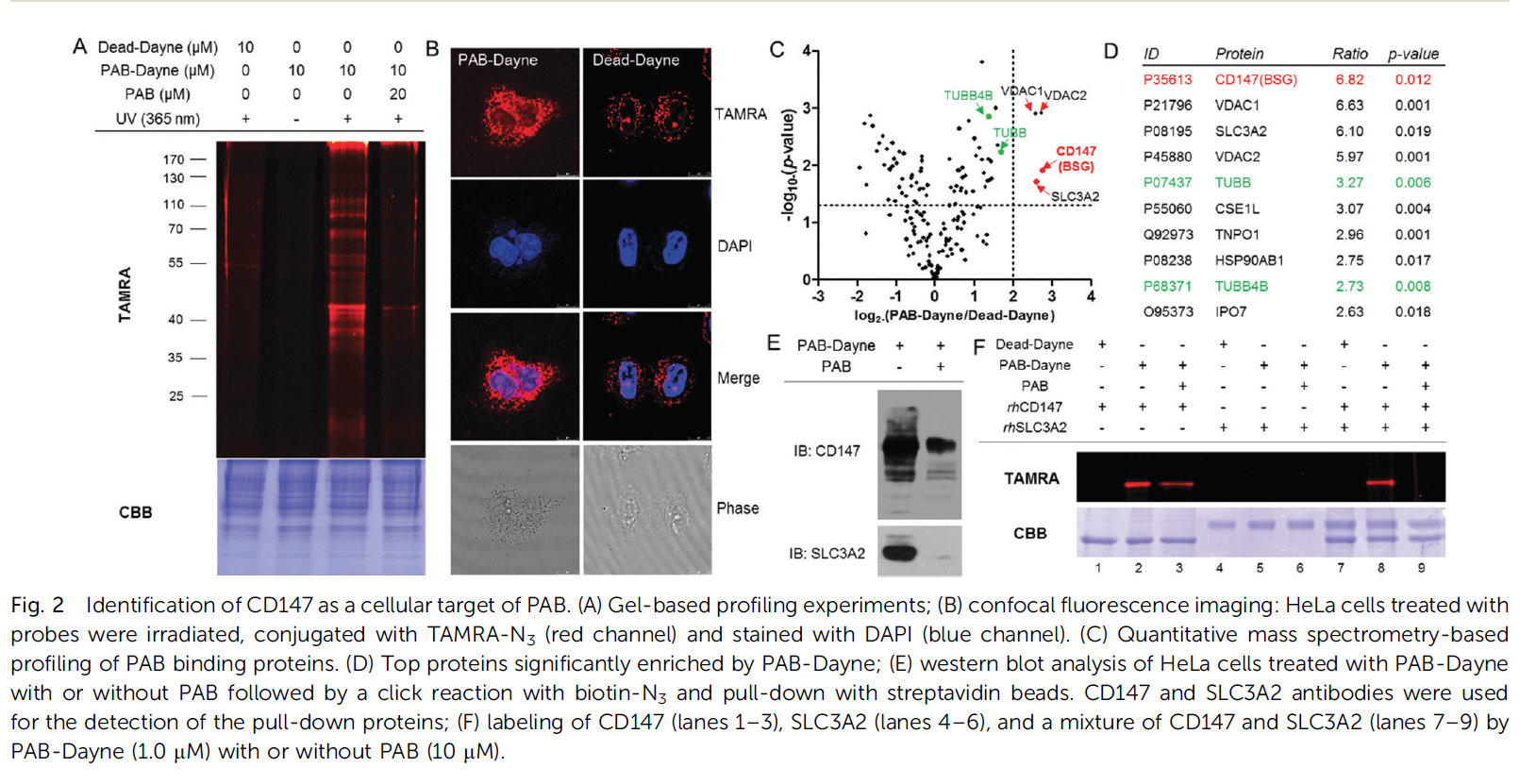
图2:CD147作为PAB细胞靶点的鉴定。(A) 共焦荧光成像:用探针照射HeLa细胞,与TAMRA-N3(红色通道)结合,用DAPI(蓝色通道)染色。(C) 基于质谱的PAB结合蛋白定量分析。(D) PAB-Dayne显著富集的Top蛋白;(E)PAB-Dayne处理HeLa细胞后与生物素-N3的点击反应和链霉亲和素珠的下拉反应的western blot分析。CD147和SLC3A2抗体用于检测下拉蛋白;(F)用PAB Dayne(1.0 mM)标记CD147(1-3车道)、SLC3A2(4-6车道)以及CD147和SLC3A2(7-9车道)的混合物(10 mM)。
结果:在PAB-Dayne处理的细胞中,除细胞核外,整个细胞都观察到强荧光信号,在死亡的Dayne处理的细胞中检测到弱信号,提示大多数信号源于PAB-Dayne标记的蛋白质(图2B)。
3:接下来,我们进行了大规模的下拉/LC-MS实验,使用基于亲和性的分析来识别PAB的目标。光标记HeLa细胞裂解并与生物素N3结合。链霉亲和素微珠富集后,酶切结合蛋白,用相应的定量试剂标记酶切产物,通过LC-MS/MS进行汇集和分析,以减少假阳性靶点,我们生成了相应的火山图,并根据它们的比率(PAB Dayne/Dead Dayne 4 4)和显著性(p值0.05)过滤蛋白质(图2C)。两种微管蛋白亚型(TUBB和TUBB4B)的比例略低于阈值。四支安打,包括CD147、SLC3A2、VDAC1和VDAC2,被揭示为PAB的潜在目标(图2D)。为了研究PAB、CD147和SLC3A2之间的相互作用,我们用重组蛋白进行了光标记实验(图2F)。
4:为了进一步确定PAB结合的关键残基,用LC-MS/MS消化和分析标记为CD147的PAB Dayne。发现肽76VDSDDQWGEYSCFLPEPMGTANIQLHGPPR106(Uniprot ID:P35613-2)经共价修饰,与未经修饰的肽片段相比质量增加523.26(PAB Dayne,损失N2),ESI)。根据HCD裂解后形成的大量y型离子,明确地确定了氨基酸序列。MS2光谱的进一步分析将标记定位于V76或D77(图3A)。如对接模型所示,这些残基属于CD147的N-末端胞外结构域内的免疫球蛋白C-2型(IgC2)结构域(PDB ID代码:3I85,图3B),在其齐聚和细胞功能中起着关键作用。将CD147加入不同浓度的PAB,在不煮沸的情况下进行SDS-PAGE分析。Western blot分析清楚地表明,0.1mm的PAB足以破坏CD147的齐聚(图3C)。PAB能以剂量依赖的方式减少MMP-2、MMP-7和MMP-9的表达(图3D)。western blot证实了CD147的敲除(图3E),并导致PAB在1.0 mM处引起的细胞毒性明显降低(图3F)。
图3:CD147作为PAB靶点的结合位点鉴定与验证。(A) PAB-Dayne修饰肽的MS2谱;(B)PAB与CD147的胞外IgC2结构域(PDB-ID代码:3I85)对接;(C)PAB体外阻断CD147的齐聚;(D)PAB剂量依赖性抑制HeLa细胞中MMPs的表达;(E)western blot分析证实CD147基因敲除。用加扰siRNA处理的细胞为阴性对照(NC);(F)用NC或cd147sirna转染HeLa细胞,用不同浓度的PAB处理24小时,用细胞滴度Glos荧光试剂盒测定细胞活力。
结果:10 mM的PAB对CD147-和NC-siRNA处理的细胞毒性差异的影响较小,表明存在额外的靶点(如微管蛋白)。结果提示CD147参与了PAB的细胞毒性。
5:最后,为了进一步研究PAB的作用方式,我们进行了全局蛋白质组分析,分析PAB对HeLa细胞蛋白质表达的影响。用1.0 mM的PAB或DMSO处理细胞24小时并裂解。用胰蛋白酶消化,等压标记,LC-MS/MS分析。如图4所示,PAB处理后,39和13个蛋白质的表达量分别显著增加和减少了2倍。我们对这些蛋白质的生物过程进行了基因本体论分析。需要进一步的研究来阐明CYR61在PAB抗癌机制中的作用。此外,经PAB处理后,三种微管蛋白的细胞丰度显著降低(图4,蓝色)。
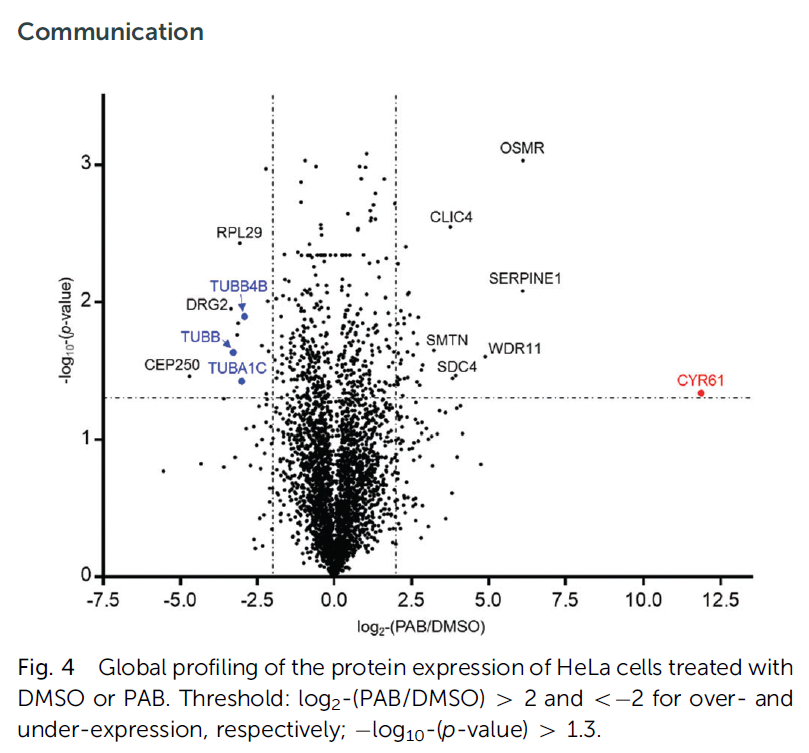
图4:DMSO或PAB处理HeLa细胞后蛋白表达的整体分析。阈值:log2-(PAB/DMSO)42和o2分别用于过表达和欠表达;log10-(p值)41.3。
结论:我们开发了一种可点击的细胞渗透性光活性探针,用于完整HeLa细胞中PAB的目标识别。通过基于化学蛋白质组学的靶点鉴定和分子/细胞验证,我们阐明PAB靶点CD147,破坏CD147的齐聚,降低MMP-2、MMP-7和MMP-9的表达水平,这被认为是肿瘤生长、侵袭和转移的必要因素。除了首次报道的PAB靶点微管蛋白外,CD147的发现可能是PAB生物学活性的另一个亚群。虽然可能有额外的分子靶点可以逃避现有的光亲和探针的检测,但这项工作强调了PAB对CD147细胞外部分的独特抑制作用,以开发新型抗癌药物。