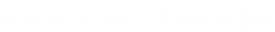Ub泛素化和SUMO化
泛素(ubiquitin, Ub)是一类高度保守的小蛋白,可与靶蛋白的赖氨酸残基共价连接,形成多聚泛素链行使功能。
类似于泛素化(Ub)修饰过程, 小泛素相关修饰物(small ubiquitin-related modifier, SUMO)也可以共价修饰靶蛋白的赖氨酸残基,从而影响靶蛋白的定位、稳定性以及蛋白间的相互作用, 发挥重要的生理功能。
泛素化(Ub)和SUMO化是蛋白质翻译后修饰的重要方式,广泛参与调节蛋白质功能和细胞生命活动各个环节。多聚泛素化降解蛋白质,而SUMO化主要调节蛋白质的相互作用和定位等。在不同情况下,SUMO化和泛素化既可协同调节蛋白质功能,也可相互拮抗。
Ub泛素化 SUMO化 修饰富集 技术流程 产品信息 案例解读
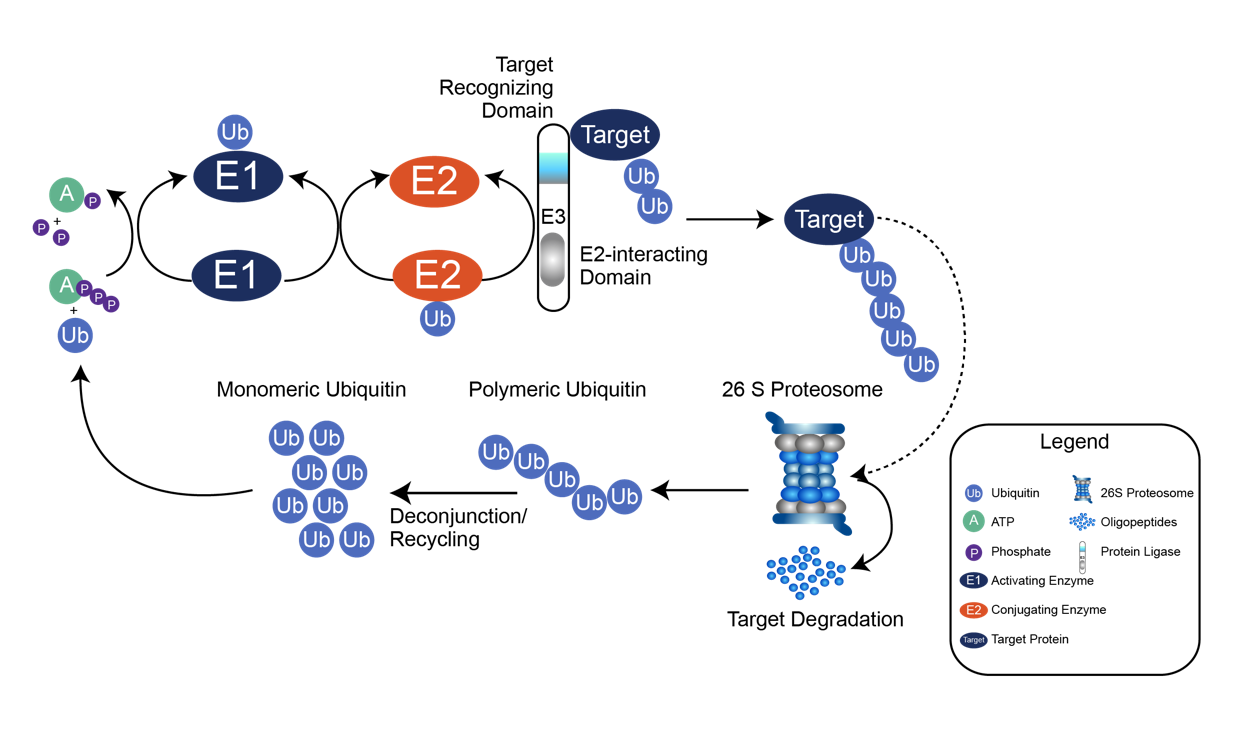
泛素化是目前研究较多的主要调控修饰之一,是指一个或多个泛素分子 (Ubiquitin, Ub) 在一系列酶 (E1、E2、E3) 的作用下与底物蛋白质分子的赖氨酸残基发生共价结合的修饰过程。泛素是真核生物中高度保守的76个残基多肽,包括7个赖氨酸残基和一个N端(M1、K6、K11、K29、K33、K48和K63),其中任何一个都可以被泛素化,从而导致多泛素链的组装。这些链具有本质上不同的结构,并导致不同的生物学功能,例如K48链导致蛋白酶体降解,而K63链则与细胞信号传输和溶酶体降解有关。由于泛素链可以由单一类型、混合甚至分支组成,因此可能存在大量不同的泛素链拓扑结构,从而导致高度复杂和多样的信号。
泛素化修饰的过程由泛素激活酶E1、泛素结合酶E2和泛素连接酶E3三种酶共同作用。E1以依赖于三磷酸腺苷的方式激活泛素,通过硫酯键将泛素转移到E1的活性半胱氨酸位点并释放单磷酸腺苷。随后,泛素与E2的活性半胱氨酸位点结合,从而使E3通过硫代酯化反应将泛素与特定蛋白上的赖氨酸残基结合。泛素化并不是基于序列识别基序,而是基于赖氨酸残基的可获得性或E3酶或E2/E3酶的特异性。
同时泛素常以不同长度、不同结合位点及不同拓扑结构结合于蛋白质,这也构成了蛋白质翻译后修饰的多样性,并调节被标记蛋白质的功能和去向。泛素化参与了真核细胞几乎所有的生命活动,是最灵活和全能的翻译后修饰。
SUMO化修饰( SUMOylation) 是一种新型的蛋白质翻译后修饰形式,在真核细胞中参与了多种重要的生理生化反应。SUMO是一种小类泛素修饰蛋白,分子量约12 kDa,它保守存在于所有的真核生物中。在脊椎动物有3个 SUMO 基因,SUMO-1、SUMO-2和SUMO-3。由于SUMO-2 和SUMO-3 的同源性高达95%,故常作SUMO-2/3。
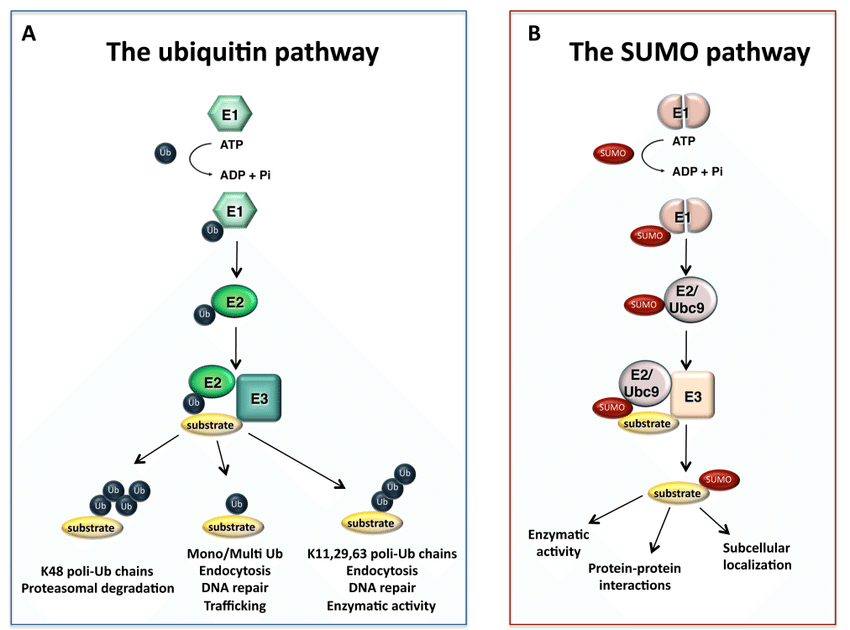
SUMO化修饰是一种由SUMO特异性的活化酶(E1)、结合酶(E2)和连接酶(E3)共同催化完成的类泛素化修饰。同时,它又是一个动态且可逆的过程,介导去SUMO化的则是SUMO特异性蛋白酶(SENP)家族。SUMO化修饰的靶蛋白存在于细胞的各个部位,通过loss of function和gain of function机制,SUMO化修饰可调控蛋白质的活性与功能。SENPs介导的去SUMO化是决定靶蛋白SUMO化修饰水平的主要因素之一,同时SENPs也是调节蛋白SUMO化修饰的一个主要环节,因此SENPs在调控靶蛋白所参与的信号通路中发挥着重要作用。
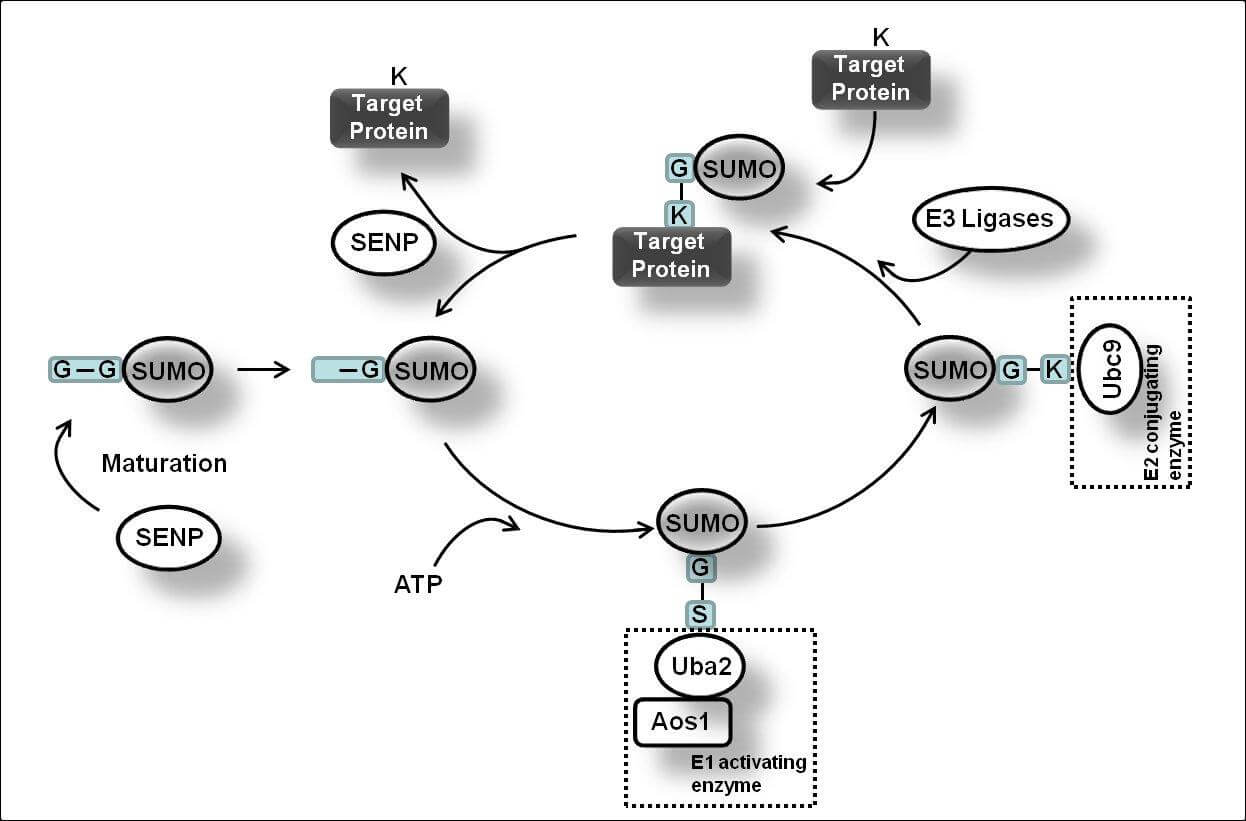
首先,SUMO的几个C-末端氨基酸被SUMO特异性蛋白酶(sentrin/SUMO-specific proteases, SENP)所降解,暴露出二甘氨酸残基并成为成熟的SUMO。接着,在ATP的调节作用下,SUMO的二甘氨酸残基与E1激活酶的半胱氨酸残基结合形成活化的SUMO。E1酶是ATP依赖性异二聚体,由人类细胞中的SUMO活化酶亚基1(SAE1)和SUMO活化酶亚基2(SAE2)构成。SAE1/SAE2可以特异性地识别目前已知唯一的E2结合酶(Ubc9),通过酯交换反应,SUMO被转移到Ubc9的半胱氨酸残基上,形成高能硫酯键。最后,在E3连接酶的催化作用下,Ubc9直接识别底物蛋白的保守序列Ψ-KxD / E(Ψ是疏水基团,K是与SUMO偶联的赖氨酸,x是任何氨基酸,D / E是由底物中的天冬氨酸或谷氨酸组成的酸性氨基酸),将SUMO与底物的赖氨酸残基结合形成异肽键,最终完成了SUMO和底物蛋白之间的特异性结合。目前,已发现三种类型的E3连接酶,Ran结合蛋白2(RanBP2)、活化的STAT蛋白抑制剂( PIAS)和多梳蛋白2(Pc2),这些连接酶都具有增强Ubc9和底物之间识别的能力。此外,结合的SUMO可以通过SENP与底物的赖氨酸残基解离以参与新一轮的SUMO化修饰,这个过程被称为去SUMO化。目前已知有6种SENPs,包括SENP1/2/3/5/6/7,SENP1/2主要解离SUMO1-3,SENP3/5主要识别SUMO2/3以及使SUMO2/3从底物上移除,SENP6/7主要介导多聚SUMO链的去SUMO化。综上,SUMO化和去SUMO化一起构成完整的可逆酶促反应,通过SUMO与底物的结合、解离进一步调节各种细胞生物过程。
泛素化肽的质谱检测是通过对样品的蛋白水解消化来实现的,由于泛素的两个C端甘氨酸残基与赖氨酸残基相连接,胰蛋白酶会在赖氨酸的末端切割,而产生具有特征的二甘氨酸(diGly)信号。因此,与未修饰的肽相比,泛素化肽的质量增加了114.0429 Da,这也使得预测泛素化位点成为可能。泛素化修饰的鉴定和定量同样需要对样本进行富集,目前以抗体居多,目前常用的泛素化蛋白纯化方法为K-ɛGG 抗体法。富集抗体可靶向胰蛋白酶消化后遗留在泛素化赖氨酸残基上的二甘氨酸残基 (K-ε-GG)。
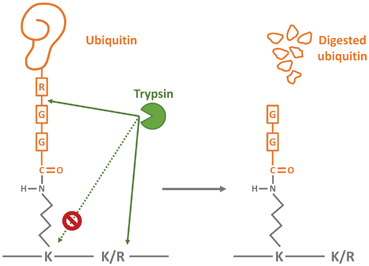
该泛素残基基序抗体可在对数千个非冗余的泛素化序列进行 LC-MS/MS 定量分析之前,用于富集胰蛋白酶消化样品中的泛素化肽。
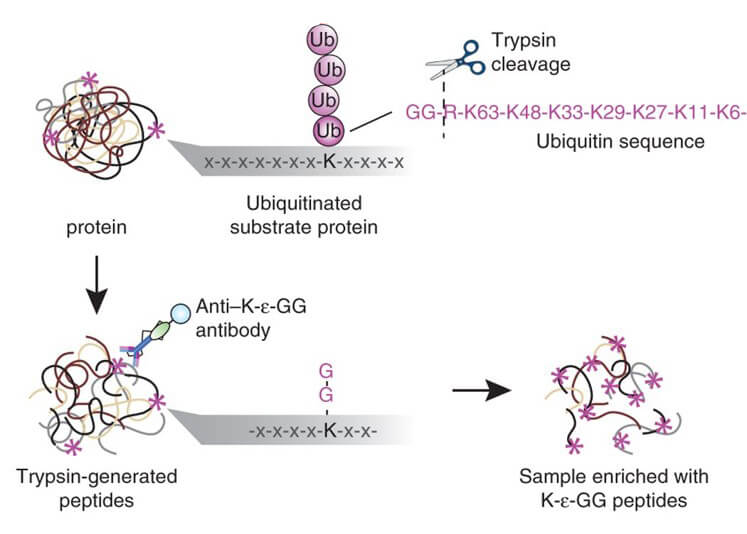
SUMO 化翻译后修饰是指SUMO 的C 端双Gly 与靶蛋白上Lys 侧链ε-NH2 通过异肽键共价连接的过程。鉴于SUMO化所有四个家族成员的C末端的两个甘氨酸前面都是苏氨酸(T),可使用特异 WaLP蛋白酶对 SUMO 化蛋白进行酶解,从而得到产生双甘氨酸 (K-ε-GG)残基(WaLP对于A,T,S和V这四种氨基酸的C末端有非常高的酶切倾向性;并且WaLP对于碱性氨基酸H,K和R的相对酶切能力几乎为零。这是一项对于SUMO化修饰富集非常重要的特性,因为只有WaLP蛋白酶对T的C末端而不是精氨酸的C末端有选择性的酶切倾向时,才可以富集到的带有KGG残基的肽段才会是来自于SUMO化修饰而不是泛素化修饰)。这种残基会示踪在 SUMO 化底物的赖氨酸残基上。随后使用针对泛素分析而开发出的K-ε-GG泛素残基基序抗体进行SUMO化肽段富集。

泛素化修饰蛋白质组学:
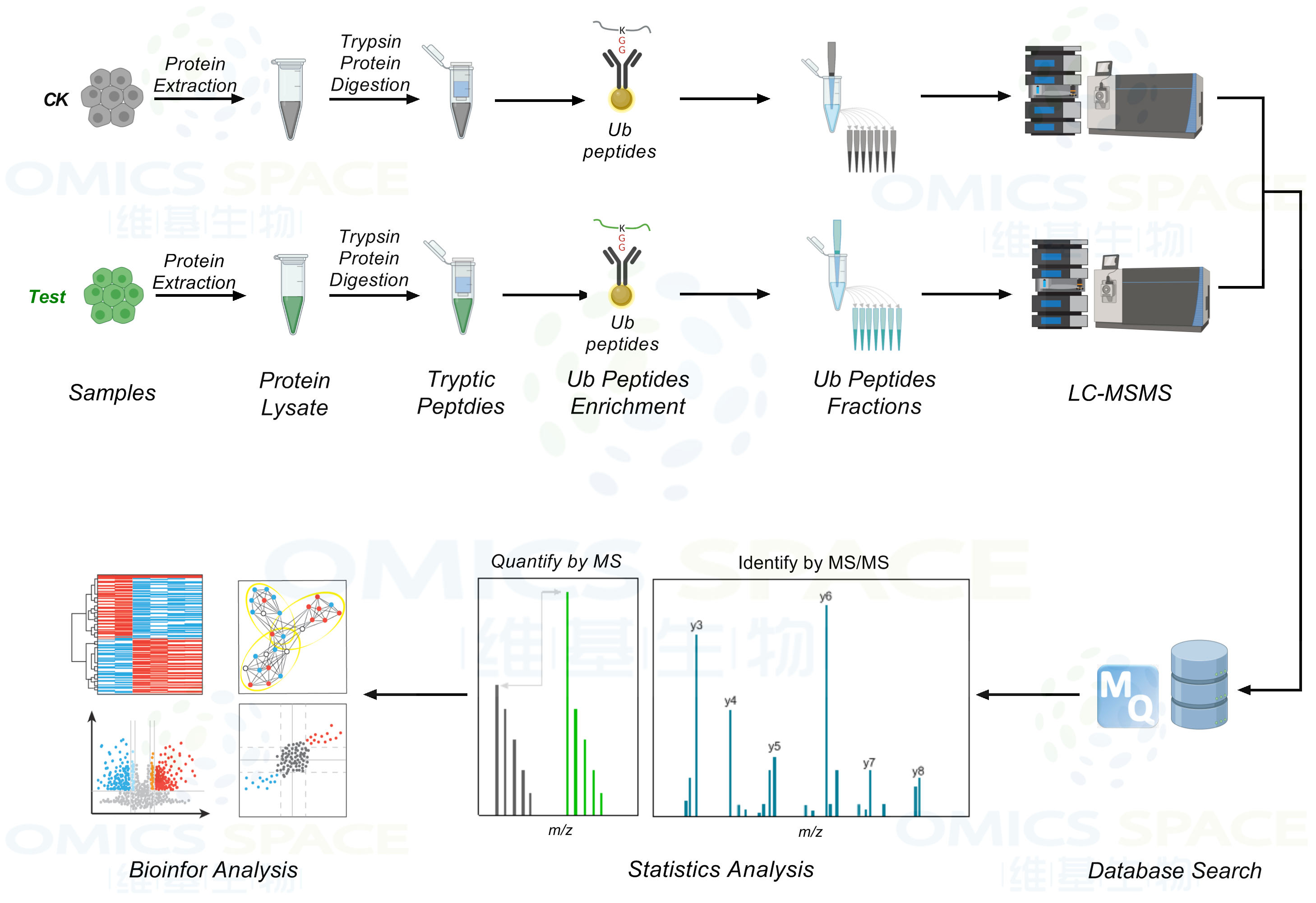
SUMO修饰蛋白质组学:
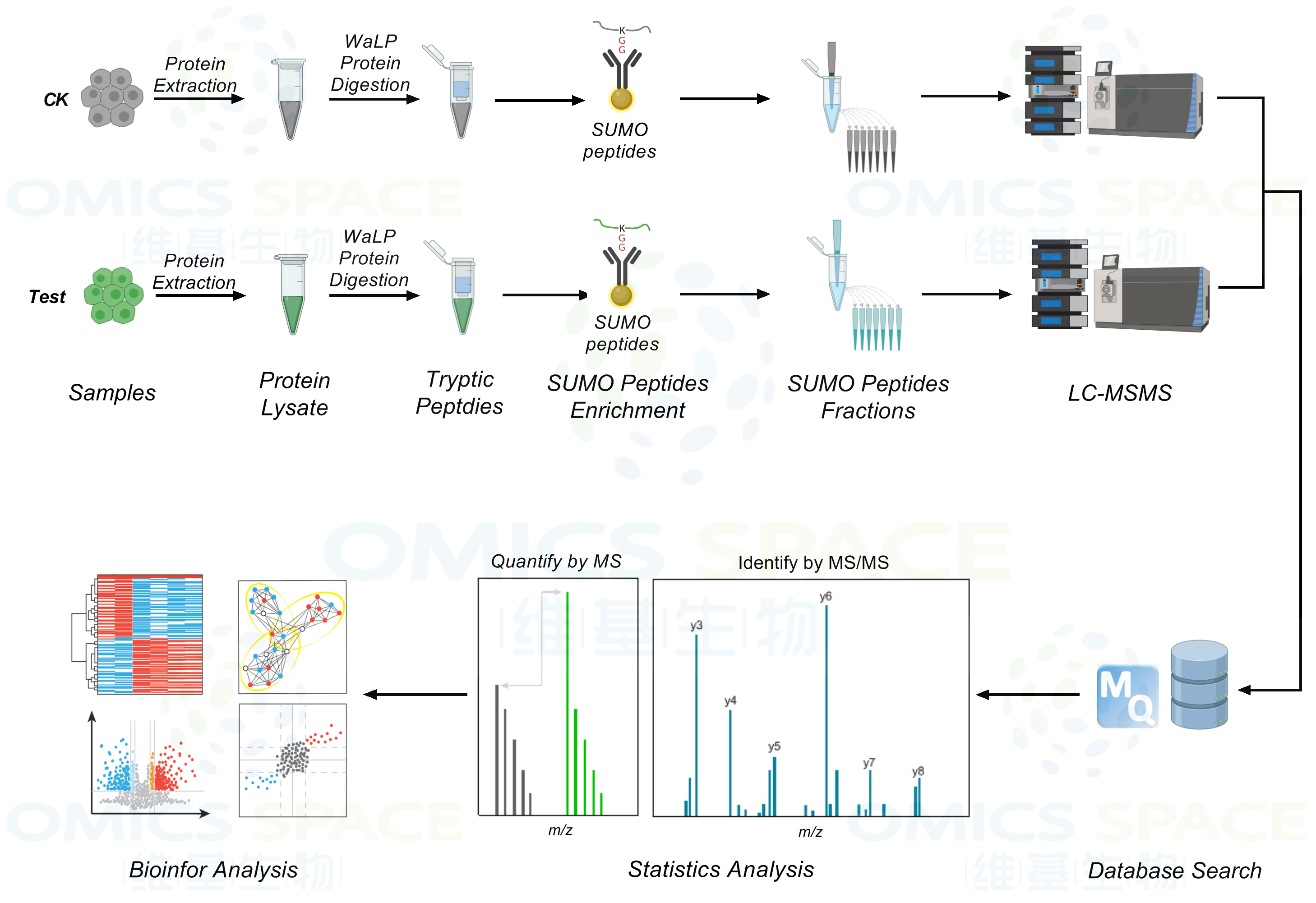
1.产品描述:大规模泛素化/SUMO化修饰蛋白质组学-对客户提供的不同组别的样本进行泛素化/SUMO化修饰蛋白质组学分析,鉴定获得所有样本的泛素化/SUMO化修饰位点/肽段/蛋白信息,定量筛选不同组别样本之间显著性差异表达的泛素化/SUMO化修饰位点,并对相关酰化修饰蛋白进行生物信息学分析。
2.样品要求:
2.1. 常规人、动物组织(比如肝脏、肾脏、脑组织等):≥2g;
2.2. 软体动物:≥2g;
2.3. 动物坚韧组织(软骨、毛发等):≥5g;
2.4. 植物叶片等鲜嫩组织:湿重≥5g;
2.5. 植物富含杂质或蛋白含量低的样本,如植物根,根茎、木质部、韧皮部组织等:干重≥10g;
2.6. 植物花粉:≥400mg;
2.7. 藻类组织:≥5g;
2.8. 细胞样本数目须达到:2*107(建议使用本公司的裂解液进行裂解之后再进行寄送);
2.9. 微生物菌类:≥300µL纯菌体;
2.10. 体液类(唾液、羊水、脑脊液等)10 mL以上,不能溶血;血清500 μl以上;尿液50 mL以上。
2.11. 其他特殊样本如有疑问请联系我们。
3.质谱信息:Orbitrap Fusion(Thermo Scientific),Orbitrap Elite(Thermo Scientific)
4.测试周期:30个工作日
5.报告信息:测试报告、修饰位点/肽段/蛋白质鉴定列表(电子版)、显著性分析列表(电子版)、生物信息学报告、原始质谱测试文件
6:生信分析:
6.1. 质谱数据质量分析
6.2. 显著性差异统计分析
6.3. GeneOntology注释和富集分析
6.4. KEGG注释和富集分析
6.5. 蛋白质互做网络PPI分析
6.6. 蛋白修饰PTM分析