技术文档
Glycoproteomics前沿研究分享
注:文章摘自Orbitrap组学俱乐部
蛋白质糖基化(glycosylation)是一种最常见和最重要的翻译后修饰,随着Orbitrap技术的发展,糖蛋白质组学的研究已经不满足于N-糖蛋白的鉴定,越来越多的文献报道了运用Orbitrap高分辨质谱鉴定N-糖肽和O-糖肽,并与生物学功能关联起来。本期小编给您推荐三篇糖蛋白质组学的高水平文章。
1.Terminal galactosylation and sialylation switching on membrane glycoproteins upon TNF-alpha-induced insulin resistance in adipocytes. Molecular Cellular Proteomics. 2015, Manuscript M115.054221
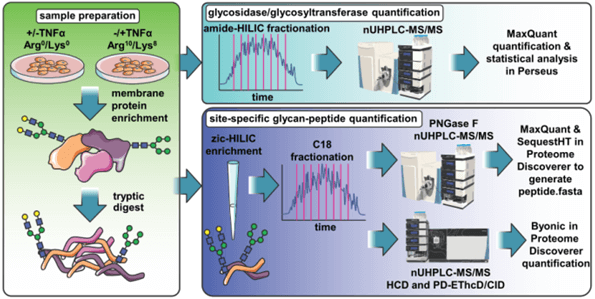
该文章发现在TNF-alpha诱导胰岛素抵抗的脂肪细胞中,糖蛋白糖链末端的di-Gal是升高的,alpha-2,3-唾液酸降低,对应B4GalT5和Ggta1糖基转移酶升高,ST3Gal6唾液酸转移酶降低,通过N-糖肽的定量分析鉴定发生变化的N-糖链接的蛋白信息。文章主要的技术手段是SILAC全蛋白质组学分析、SILAC糖蛋白质组学分析和SILAC N-糖肽定量分析。
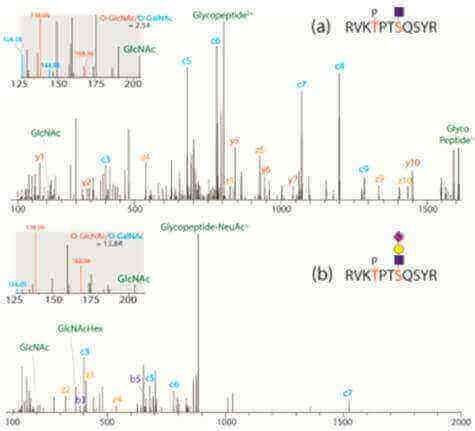
2.Extended O‑GlcNAc on HLA Class-I-Bound Peptides. Journal of the American Chemical Society. 2015,137(34):10922-5
这篇文章用体外实验、质谱、分子对接手段第一次发现了HLA-calss I 结合肽段上发生了O-GlcNAC修饰。在细胞内O-GlcNAC修饰一般不会再结合其他糖链,形成多聚糖,但是HLA-class I 复合物上会发生O-GlcNAC多聚糖修饰,该文章同时也解释了HLB-class I发生O-GlcNAC修饰的生化过程。
3.An innate antiviral pathway acting before interferons at epithelial surfaces.Nature Immunology. 2015
该文章主要发现了病毒入侵先天免疫的另外一条通路。一般认为干扰素构成了先天免疫的第一条防线,但是在干扰素起作用之前,病毒表面O-链接蛋白链能够激活中性粒细胞CXCR3等趋化因子,形成一道新的防御系统。该文章通过PNA凝集素富集O-糖蛋白,chymotrypsin 酶切,Orbitrap Fusion三合一质谱系统鉴定了HSV-2的O-糖蛋白质组,并用糖苷酶处理HSV-2,证明CXCR3表达依赖于HSV-2表面的O-糖链。