文献解读
项目文章|发现嵌合蛋白在维持扇贝足丝结构完整性方面起着凝聚作用-Scientific Reports-201812
水下生物粘附是海洋固着生物的必不可少的生物过程,据认为对于移动,食物采购,国防,变态和附着至关重要。弄清海洋生物粘合剂的组成和组装是了解其生理作用的基础。在这里,从囊的关键部分(足丝基底)发现了一种新型蛋白(Sbp9),该蛋白含有两个钙结合结构域(CBD)和49个串联表皮生长因子样(EGFL)结构域重复序列。这项研究不仅有助于了解椎弓丝的组装,而且还将启发仿生材料的设计。


为了揭示足丝根部的蛋白质组成,从扇贝的足丝根部提取蛋白质,经SDS-PAGE分析后,观察到两个主要谱带(图2a)。切割这两个条带(条带1和2)分别进行质谱分析。总共,从扇贝的足丝根部提取物中鉴定出21种特征性肽段≥2的蛋白质。蛋白质Sbp9是扇贝足丝根部的主要和关键成分。进一步研究了全长Sbp9基因序列,结果发现全长Sbp9包含6099bp,编码2033个氨基酸。功能域分析表明,Sbp9包含两个CBD域(CBD1和CBD2),其侧翼是49-EGFL重复域(图2b)。为了研究源自Sbp9的EGFL的序列特征,对所有49个EGFL域进行了多个序列比对,结果表明,这些保守EGFL重复序列的一个重要特征是在前两个Cys残基处存在PCGGPC基序,与鞭毛状丝中GPGGX的主要亚重复非常相似。

使用多克隆抗CBD1抗体进行了免疫组织化学。结果表明,荧光信号主要限于根部,而在其他区域则几乎没有信号A,表明Sbp9主要位于足丝根部,但是Sbp9在扇贝的足丝中的作用仍然是未知的。

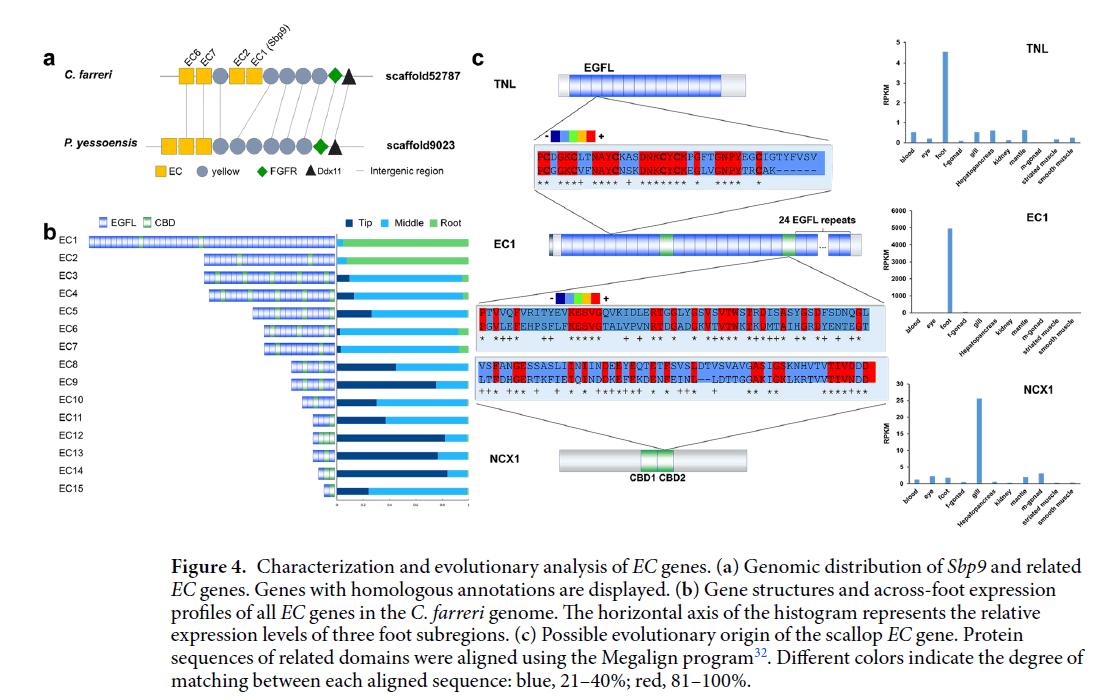
作者随后通过拯救试验,用EDTA/DTT处理被用来破坏扇贝足丝内可能的相互作用。EDTA/DTT处理后,附生足丝变得更加透明,表明根部的超微结构被破坏了。进一步的TEM可视化表明,均匀的纤维变得疏松,这导致了根部纤维的结构遭到破坏(图5b)。同样,附根蛋白中的卷曲比例降低,β-折叠比例增加(图5c和),表明EDTA / DTT处理破坏了足丝根部的完整性,并且破坏了根部中纤维内的分子间相互作用。为了比较Ca2+在分解基底蛋白中的作用,将EGFL4或Ca2+分别添加到EDTA/DTT处理的样品中。显然,Ca2+的添加能够部分恢复根部纤维之间的结构,而仍存在不规则的高电子致密颗粒,与EDTA/DTT处理组相比,未观察到明显的二级结构变化。并且添加EGFL4能够部分恢复自然的超微结构,而二级结构几乎恢复了自然的状态。因此,可以得出结论,当添加EGFL4或Ca2+时,附生根部分恢复了自然结构,但是BSA对照没有观察到显着变化。这表明,EGFLs在足丝根部中具有内聚作用。
该研究着眼于重要但尚未开发的扇贝足丝,发现了具有独特模块化结构的关键蛋白(Sbp9),其出现可能与基因融合过程有关。Sbp9中存在游离硫醇,救援实验的结果表明Sbp9在维持扇贝扇贝完整性方面起着凝聚作用。这项研究提供了一种主要的扇贝足丝蛋白的首次综合表征,将有助于理解扇贝足丝的形成。另外,特征化的独特模块架构可潜在地用于仿生材料的设计中。