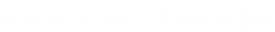文献解读
项目论文|蛋白质组学在免疫修饰磁珠对外泌体高效捕获和温和释放分子机制的研究-Nanoscale-201808
外泌体通常被认为是大小在30至150 nm范围内的磷脂双层囊泡,可通过各种细胞类型分泌,并释放到细胞外环境中,例如脑脊液,尿液,血液以及体外细胞培养基。与外泌体相关的参与细胞间通讯的新兴证据表明,外泌体在各种病理和生理过程中起着至关重要的作用,例如信号转导,免疫应答,肿瘤的发生,侵袭和转移。特别是,外泌体中的生物实体例如蛋白质和微小RNA,也为疾病的预测,预后和诊断提供了丰富的生物标志物。尽管有关细胞培养上清液和各种体液中的外泌体成分的研究越来越集中,但目前,要高效的分离纯净的外泌体,用于个性化诊断和治疗目的对富集的外泌体进行下游分析,仍然是很困难的 。外泌体的研究对于癌症的诊断和预后具有重要意义,其中,由于外泌体在体液中的浓度极低,因此无损伤地分离外泌体是至关重要的一步。
本文中,通过β-环糊精(β-CD)和4-氨基偶氮苯(AAB)之间的主客体相互作用,通过将抗体与超顺磁性纳米粒子结合,成功构建了免疫亲和超顺磁性纳米粒子(IS-NP)。细胞培养上清液或体液中的外来体可以被IS-NP有效捕获,然后被竞争性宿主分子α-CD轻度洗脱。
材料:六水合氯化铁,牛血清白蛋白,N-羟基琥珀酰亚胺(NHS),聚丙烯酸
目的:通过主客体相互作用进行免疫修饰的超顺磁性纳米粒子,实现外泌体高纯度捕获和轻度释放,并且尽量保留外泌体结构和功能的完整。
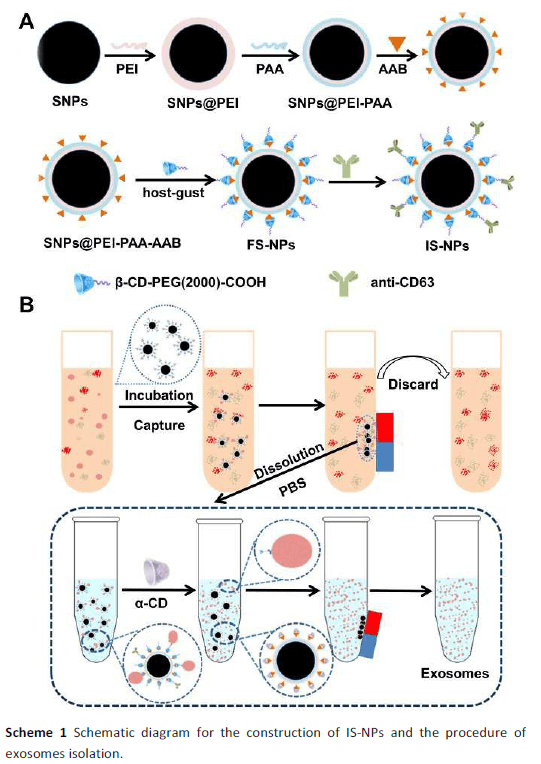
实验:通过LC-MSMS对IS-NP和超速离心分离的外泌体蛋白进行了三个生物重复的比较分析。通常,我们编码前100个基因,以鉴定每个样品具有高生物重现性的前115个蛋白质。对IS-NPS捕获的来自4T1细胞的外泌体蛋白质进行质谱分析显示,这些蛋白质中约有89.6%(115个中的103个)已被表征为外泌体蛋白质。但是,超速离心分离的外泌体蛋白中只有69.6%(占115种蛋白中的80种)被表征为外泌体蛋白(图5B)。因此,外泌体蛋白质的比例越高,外泌体样品的纯度就越高。这些结果表明,在从相关的4T1细胞培养上清液中分离外泌体时,我们基于IS-NPs的外泌体的分离功效优于金标准的基于UC的方法。
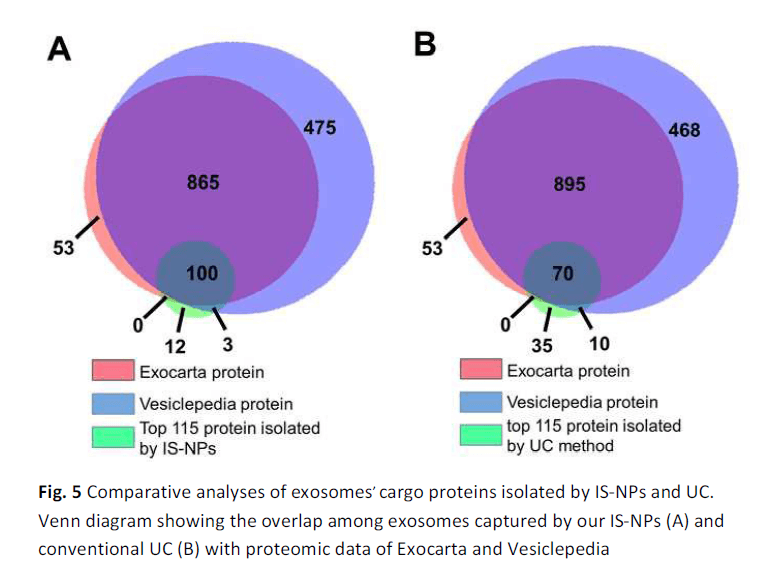
通过外泌体细胞摄取来证明被IS-NPs分离的外泌体的生物学完整性。IS-NPS从MCF-7细胞培养上清液中捕获的外泌体用PKH67标记,并与MCF-7细胞孵育不同小时。 CLSM跟踪外泌体的细胞内定位。 如图所示,外泌体在3小时后在细胞质内显示弱的荧光信号(绿色),这证明被IS-NP捕获的外泌体被MCF-7细胞摄取。孵育6小时后,外泌体信号(绿色)变得更强。考虑到已经研究过的纳米材料(FS-NP)与MCF-7细胞的生物相容性,这些细胞摄取结果表明外泌体被捕获,说明通过IS-NP分离的外泌体具有出色的稳定性和生物完整性。
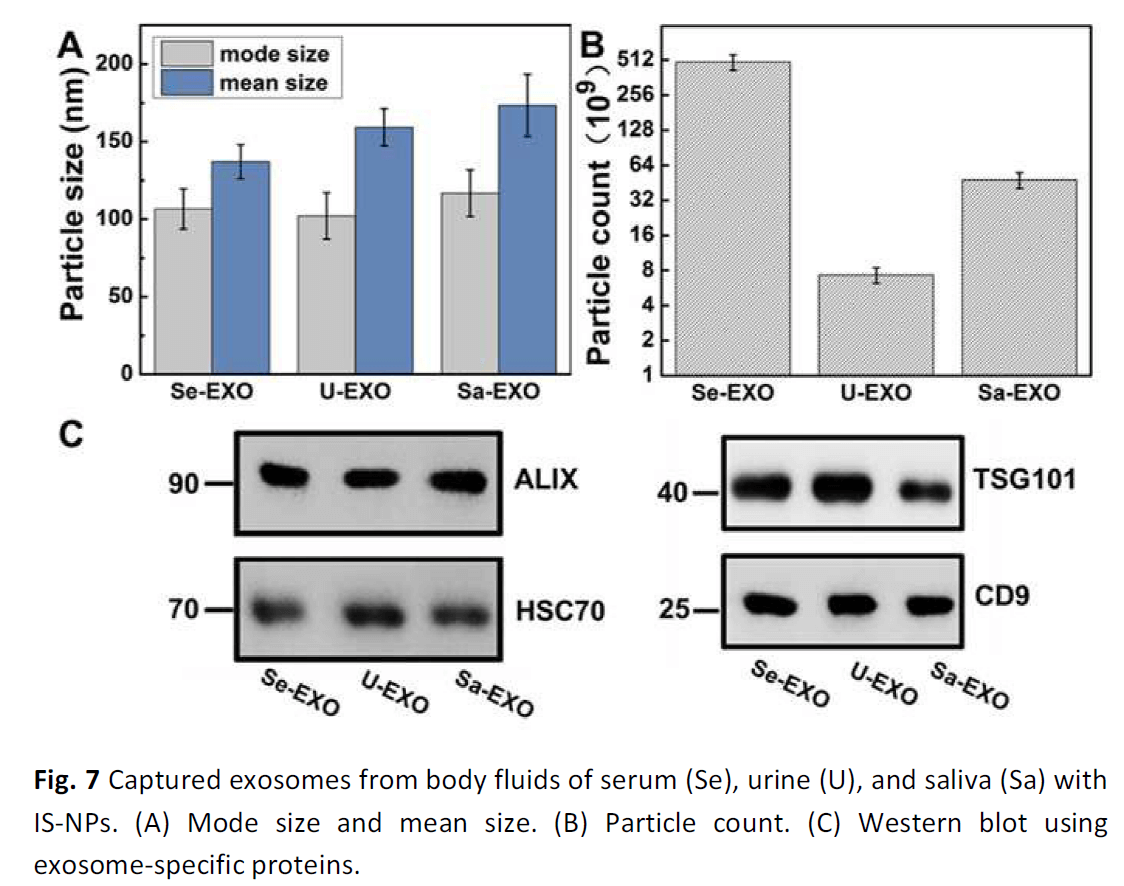
通过NTA测量每个外来体样品中颗粒的大小和计数。如图7A所示,IS-NPs从体液中捕获的外泌体的平均大小略大于其他样品的众数大小。有趣的是,与从尿液(7.3±1.5×109)和唾液(47.9±7.4×109)捕获的外泌体相比,从血清(493.4±75.2×109)捕获了约一百倍和十倍(图7B)。这些结果与以前的报道一致,即每天在血流中检测到网状细胞释放的大量外泌体,表明血液可能是更好的来源。外泌体。同样,外泌体标记(ALIX,HSC70,TSG101和CD9)也用于蛋白质印迹,以确认成功获得目标外泌体(图7C)。这些结果表明,IS-NP可用于从各种生物来源捕获高纯度的外泌体。
结论:IS-NPs从含有不同浓度外泌体(1011~107外泌体/mL)的模型样品中捕获了约80%的外泌体。洗脱后,捕获的外泌体的释放效率高达86.5%。通过对IS-NP,传统的超速离心(UC),基于聚乙二醇(PEG)的沉淀和市售试剂盒分离的外泌体进行了比较,以检查IS-NPs外泌体分离的性能。 IS-NPs捕获的外泌体的颗粒蛋白比(8.8±1.3×109)比UC(1.1±0.4×109)高八倍,是基于PEG的沉淀的两倍以上(3.7±0.8×109)和市售试剂盒(3.2±0.8×109)分离得到的试剂盒显示,IS-NP比所有其他三种方法产生的外泌体纯度更高。细胞摄取实验表明,被IS-NP捕获的外泌体保留了其结构和功能完整性,因此在生物医学领域的广泛应用可能值得期待。这种涉及免疫亲和磁性颗粒系统的主客体相互作用可以为快速,高效和高纯度的外泌体分离和洗脱提供新的途径,进一步有益于外泌体在所需领域的应用。